Białka integralne
Białka integralne – białka błonowe (lub ich agregaty) trwale związane z błoną biologiczną. Takie białka mogą być z niej wyizolowane tylko przy użyciu detergentów[1], rozpuszczalników niepolarnych lub czasami czynników denaturujących.
Prawdopodobnie aż 30% białek kodowanych w ludzkim genomie stanowią białka błonowe[2][3][4], z czego większość stanowią integralne białka błonowe.
Struktura[edytuj | edytuj kod]
Obecnie poznano jedynie około 160 różnych struktur integralnych białek błonowych z wysoką rozdzielczością dostępną za pomocą metody dyfrakcji rentgenowskiej lub spektroskopii magnetycznego rezonansu jądrowego. Wiąże się to z trudnościami z izolacją takich białek i ich krystalizacją w środowisku pozabłonowym. Rozwiązaniem może być użycie technik rekonstytucji w kryształach 2-D[3] przy uzyskiwaniu materiału odpowiedniego do technik dyfrakcyjnych – wciąż jednak nie wynaleziono przełomowej metody badania struktury takich białek. Baza struktur białkowych (Protein Data Bank) zawiera dodatkowo rozpuszczalne w wodzie domeny białek integralnych (które są łatwiejsze do krystalizacji), jednak takie podejście pozbawia takie struktury kluczowej informacji, jaką stanowią fragmenty kotwiczące.
Integralne białka błonowe można podzielić na dwie grupy:
- białka przezbłonowe
- białka nieprzebijające błony
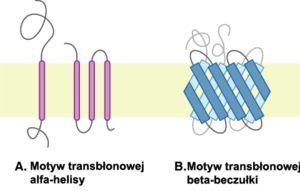
Co znamienne, dla wszystkich znanych obecnie białek integralnych poznano jedynie dwa różne motywy ich kotwiczenia w błonie: strukturę helisy α lub beczułki β – co wymusza silnie hydrofobowy charakter lipidowej części błony. Struktury te wymuszają skierowanie polarnych łańcuchów bocznych aminokwasów danego białka do wnętrza struktury, co najczęściej daje efekt polarnego kanału pozwalającego na przepływ odpowiednich polarnych cząsteczek.
Białka przezbłonowe[edytuj | edytuj kod]
Białka przezbłonowe przebijają całą grubość dwuwarstwy. Bardziej powszechna grupa białek integralnych.
Białka nieprzebijające błony[edytuj | edytuj kod]
Dzielą się na białka listka (monowarstwy) wewnętrznego i zewnętrznego. Swoistą podgrupą białek nieprzebijających błony są jej białka wewnętrzne, ulokowane pomiędzy dwoma monowarstwami, w części hydrofobowej.
Funkcja[edytuj | edytuj kod]
Białka integralne pełnią cały szereg różnorakich funkcji w komórkach. Można wśród nich odnaleźć kanały, przenośniki, pompy, receptory, enzymy, białka strukturalne, białka uczestniczące w przemianach energetycznych w komórce, białka adhezyjne i wiele innych.
Przypisy[edytuj | edytuj kod]
- ↑ Helenius A., Simons K. Solublilization of membrane proteins by detergents Biochim. Biophys. Acta 415 (1975) 29-79
- ↑ Biochim. Biophys. Acta 1565 (2002) 143 (Editorial)
- ↑ a b J.-L. Rigaud Membrane proteins functional and structrural studies using reconstituted proteoliposomes and 2-D crystals Brazilian J. of Med. and Biol. Resarch 35 (2002) 753-766
- ↑ J.U. Bowie Stabilizing membrane proteins Curr. Opin. in Struct. Biol. 11 (2001) 397-402
Bibliografia[edytuj | edytuj kod]
- Booth, P.J., Templer, R.H., Meijberg, W., Allen, S.J., Curran, A.R., and Lorch, M. 2001. In vitro studies of membrane protein folding. Crit. Rev. Biochem. Mol. Biol. 36: 501-603.
- Bowie J.U. 2005. Solving the membrane protein folding problem. Nature 438: 581-589.
- Capaldi R.A., Green D.E. Membrane proteins and membrane structure FEBS Lett. 25 (1972) 205-209
- Popot J-L. and Engelman D.M. 2000. Helical membrane protein folding, stability, and evolution. Annu. Rev. Biochem. 69: 881-922.
- Protein-lipid interactions (Ed. L.K. Tamm) Wiley, 2005.
