Pomostowanie aortalno-wieńcowe

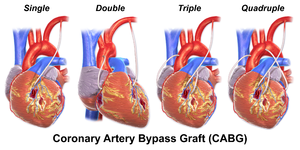
Pomostowanie aortalno-wieńcowe (CABG – ang. coronary artery bypass grafting) – kardiochirurgiczna operacja wszczepienia pomostów naczyniowych (tzw. bajpasów) omijających miejsce zwężenia lub zamknięcia w tętnicy wieńcowej, które nie nadaje się do angioplastyki ze stentowaniem, stosowana w niektórych przypadkach zawału serca i zaawansowanej chorobie wieńcowej[1].
Wytworzenie sztucznych połączeń (bezpośrednich lub pośrednich) między tętnicą główną a tętnicami wieńcowymi, omijających miejsca zwężenia, zapewnia poprawę ukrwienia niedokrwionego obszaru mięśnia sercowego.
Technika[edytuj | edytuj kod]
Materiałem do utworzenia pomostu może być tętnica, lub żyła chorego, na przykład: tętnica piersiowa wewnętrzna (ITA) lewa lub prawa, lub żyła odpiszczelowa, pobrana z podudzia chorego, a w wybranych przypadkach tętnica promieniowa, pobrana z przedramienia, tętnce jamy brzusznej, albo sztuczne naczynie. W ciągu ostatnich 40 lat XX w. operacja pomostowania naczyń wieńcowych stała się jedną z najbardziej skutecznych i najczęściej wykonywanych procedur chirurgicznych[2].
Operację pomostowania tetnicy wieńcowej z użyciem lewej tętnicy piersiowej wewnętrznej po raz pierwszy wykonanał w 1964 Wasilij Kolesow w Leningradzie. Należy pamiętać, że od 25 lutego 1964 do 9 maja 1967 oddział chirurgii kierowany przez Wasilija I. Kolesowa był jedynym miejscem na świecie, w którym wykonywano planowane operacje wszczepiania tętnicy piersiowej wewnętrznej bezpośrednio do tętnic wieńcowych[2][3][4].
Operacja CABG z użyciem żyły odpiszczelowej chorego została po raz pierwszy przeprowadzona przez argentyńskiego kardiochirurga René Favaloro w Cleveland Clinic w 1967[5]. Obecnie przeprowadza się około 800 000 operacji pomostowania rocznie na świecie, z czego ponad 500 000 w samych Stanach Zjednoczonych. W 2004 roku przeszedł ją Bill Clinton[6].
Przeprowadzono również badania, które udowodniły przydatność tętnicy żołądkowo-sieciowej lewej oraz tętnicy nabrzusznej dolnej jako pomostu aortalno-wieńcowego, jednak naczynia te nie są wykorzystywane rutynowo[7][8].
W połowie lat 80. XX w. wykazano wyższy wskaźnik drożności przeszczepów ITA w porównaniu z przeszczepami żylnymi, wraz z lepszym wskaźnikiem przeżycia pacjentów, którzy otrzymali przeszczepy ITA w porównaniu z tymi, którzy otrzymali tylko przeszczepy żylne[9].
Obecnie do tego typu leczenia kwalifikowani są chorzy z chorobą wielonaczyniową, sporadycznie jednonaczyniową, u których nie można uzyskać poprawy ukrwienia mięśnia sercowego poprzez wykonanie angioplastyki wieńcowej. U pacjentów z chorobą (zwężeniami) wielu naczyń wieńcowych (stwierdzoną w badaniu koronarograficznym chorobą trójnaczyniową) przezskórna śródnaczyniowa angioplastyka wieńcowa może być obarczona wyższym ryzykiem niż operacja pomostowania aortalno-wieńcowego, a badania wskazują na przewagę w efektywności tej drugiej nad angioplastyką[10].
W ostatnich latach coraz częściej wprowadza się do leczenia chirurgicznego choroby wieńcowej procedury operacyjne cechujące się mniejszą inwazyjnością, uzyskiwaną brakiem konieczności zatrzymania krążenia (tzw. operacje na bijącym sercu) lub minimalizowaniu pola operacyjnego:
- pomostowanie tętnic wieńcowych bez użycia krążenia pozaustrojowego (ang. off-pump coronary artery bypass, OPCAB)
- małoinwazyjne pomostowanie tętnic wieńcowych (ang. minimally invasive direct coronary artery bypass, MIDCAB)
- chirurgia naczyń wieńcowych poprzez ograniczony dostęp (ang. port-access coronary artery bypass, PACAB)
- roboty kardiochirurgiczne (ang. totally endoscopic coronary artery bypass, TECAB)
- hybrydowe leczenie choroby wieńcowej, czyli łączenie zabiegów rewaskularyzacji przezskórnej, z którąś z powyższych metod.
Operacja ta, pomimo iż na przestrzeni lat stała się wręcz rutynową przy wielonaczyniowej chorobie wieńcowej i odsetek zgonów zmalał z 50% w latach 60. XX wieku do 3-5% w wieku XXI, wciąż jest operacją bardzo skomplikowaną (wiąże się zatrzymaniem akcji serca i podłączeniem podczas operacji do płucoserca).
Rehabilitacja[edytuj | edytuj kod]
Pacjent po operacji wszczepienia pomostów aortalno-wieńcowych musi przechodzić długotrwałą rehabilitację i ściśle stosować się do zaleceń obejmujących[11]:
- całkowity zakaz palenia tytoniu (i unikanie narażenia na dym tytoniowy) do końca życia
- dieta ograniczająca spożycie tłuszczów zwierzęcych i pokarmów z wysoką zawartością cholesterolu,
oraz przez okres 2 miesięcy po operacji:
- limit symetrycznego obciążenia (do 3,5 kg na stronę)
- zakaz obciążenia asymetrycznego, na przykład noszenia teczki
- zakaz podciągania lub odpychania się rękami podczas wstawania lub siadania
- zakaz rozwierania ramion ponad 90 stopni
- unikanie nadmiernego skręcania i zginania ciała
- zakaz wstrzymywania oddechu podczas wysiłku
- unikanie ruchów związanych z unoszeniem rąk ponad głowę (np. zdejmowanie rzeczy z górnych półek)
- zakaz prowadzenia pojazdów.
Rehabilitacja kardiologiczna to wielokierunkowe działanie podejmowane dla osiągnięcia najlepszego stanu fizycznego, psychicznego i socjalnego chorych po zawale serca, lub/i po zabiegach rewaskularyzacji serca.
I etap rehabilitacji kardiologicznej stanowi wczesna rehabilitacja wewnątrzszpitalna, prowadzona bezpośrednio po zabiegach na oddziałach intensywnej opieki medycznej (OIOM). Trwa 7–14 dni. Polega na stosowaniu wg. wskazań lekarskich indywidualnych ćwiczeń oddechowych i bierno-czynnych ćwiczeń małych grup mięśniowych przy łóżku chorego[11].
II etap rehabilitacji kardiologicznej jest wczesną rehabilitacją poszpitalną, która może być realizowana w szpitalu na oddziałach rehabilitacji kardiologicznej, w sanatoriach lub w warunkach ambulatoryjnych i trwa 3–4 tygodnie[11].
III etap rehabilitacji kardiologicznej prowadzony jest ambulatoryjnie. Na podstawie wyników próby wysiłkowej chorych kwalifikuje się do jednej z trzech grup. Zajęcia są dość urozmaicone. Obejmują treningi wytrzymałościowe na ergometrze rowerowym lub bieżni, ćwiczenia indywidualne w postaci marszów, marszobiegów, jazdy na rowerze, pływania, oraz gry zespołowe. Czas trwania tego etapu jest nieograniczony[11].
Przypisy[edytuj | edytuj kod]
- ↑ Mark H. Beers, Robert S. Porter, Thomas V. Jones, Justin L. Kaplan, Michael Berkwits(Redaktorzy): The Merck Manual-Podręcznik diagnostyki i terapii. Elsevier Urban&Partner, 2006, s. 757, język polski, ISBN 978-83-60290-99-6
- ↑ a b Igor E. Konstantinov: Vasilii I. Kolesov. Tex Heart Inst J. 2004; 31(4): 349–358.. www.ncbi.nlm.nih.gov. [dostęp 2023-10-19].
- ↑ Ugo Filippo Tesler - A History Of Cardiac Surgery. Cambridge Scholars Publishing, 2020, s. 73-76, https://books.google.de/books?id=IsfHDwAAQBAJ&pg=PA241&lpg=PA80&dq=dilatator+dubost&source=bl&ots=UhXQTeDvR-&sig=ACfU3U3_k4xx70HpR5xsRXM88aobEB_dNA&hl=de&sa=X&ved=2ahUKEwi4rpu9gM2BAxXNg_0HHe8WA-E4ChDoAXoECAMQAw#v=onepage&q=dilatator%20dubost&f=false ISBN 978-1-5275-4248-8
- ↑ Andrew S. Olearchyk: Vasilii I. Kolesov. J THORAC CARDIOVASC SURG 1988;96: 13-18.. www.ncbi.nlm.nih.gov. [dostęp 2023-10-19].
- ↑ Captur G, Favaloro R. Memento for René Favaloro. „Tex Heart Inst J”. 31. 1, s. 47-60, 2004. PMID: 15061628.
- ↑ John King, Sam Feist: Clinton 'recovering normally' after bypass. cnn.com. [dostęp 2010-06-04]. (ang.).
- ↑ V I Kolesov, M P Romankova, M M Drozdova, A M Sidorov: Revascularization of the myocardium by implanting arteries of the abdominal cavity. Vestn Khir Im I I Grek. 1971 May;106(5):43-48.. www.ncbi.nlm.nih.gov. [dostęp 2023-10-20].
- ↑ [https://pubmed.ncbi.nlm.nih.gov/8965443/ I V Zhbanov, S M Minkina, M V Samoĭlenko, B V Shabalkin: Autoarterial grafts for myocardial revascularization and their morphological assesment in coronary heart disease. Khirurgiia (Mosk) . 1996:(3):38-40.]. pubmed.ncbi.nlm.nih.gov. [dostęp 2023-10-20].
- ↑ F D Loop, B W Lytle, D M Cosgrove at all: Influence of the internal-mammary-artery graft on 10-year survival and other cardiac events. N Engl J Med. 1986 Jan 2;314(1):1-6.. pubmed.ncbi.nlm.nih.gov. [dostęp 2023-10-19].
- ↑ SoS Investigators. Coronary artery bypass surgery versus percutaneous coronary intervention with stent implantation in patients with multivessel coronary artery disease (the Stent or Surgery trial): a randomised controlled trial. „Lancet”. 360 (9338), s. 965-970, 2002-10-28. DOI: 10.1016/S0140-6736(02)11078-6. PMID: 12383664. (ang.).
- ↑ a b c d Olszewski Jurek - Fizjoterapia w wybranych dziedzinach medycyny. PZWL, 2007, s. 70-77, język polski, ISBN 978-83-200-4147-7
Bibliografia[edytuj | edytuj kod]
- Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie. Andrzej Szczeklik (red.). T. I. Kraków: Wydawnictwo Medycyna Praktyczna, 2005, s. 176-179. ISBN 83-7430-031-0.
