Polichlorowane bifenyle
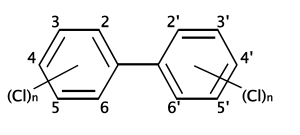
Polichlorowane bifenyle (ang. polychlorinated biphenyls, PCBs) – grupa halogenowanych organicznych związków chemicznych, pochodnych bifenylu. Jak dotąd poznano i opisano 209 różnych kongenerów z grupy PCBs, z czego ok. 130 spotyka się w mieszankach używanych komercyjnie (zazwyczaj zawierają one >50 kongenerów)[1]. W Polsce ich stosowanie jest zabronione od 30 czerwca 2010[2].
Polichlorowane bifenyle, wraz z polichlorowanymi dibenzo-p-dioksynami (ang. polychlorinated dibenzo-p-dioxins, PCDDs) oraz polichlorowanymi dibenzofuranami (ang. polychlorinated dibenzofurans, PCDFs), tworzą grupę tzw. związków dioksynopodobnych (ang. dioxin-like compounds, DLCs)[3]. Z uwagi na swoją strukturę chemiczną wszystkie DLCs wykazują charakter hydrofobowy. Ich rozpuszczalność w wodzie jest mniej więcej wprost proporcjonalna do liczby atomów chloru w cząsteczce[4].
Aby móc przedstawić toksyczność różnych DLCs w postaci wymiernej, liczne dane toksykologiczne i biochemiczne dotyczące tych substancji zostały sprowadzone do jednej wartości, tworząc w ten sposób tzw. współczynnik równoważny toksyczności (ang. toxic equivalency factor, TEF). Za punkt odniesienia przyjęto najbardziej toksyczną dioksynę, tj. 2,3,7,8-TCDD, która przyjmuje wartość 1. Toksyczność innych kongenerów określa się współczynnikami, mającymi postać ułamków dziesiętnych[5][6]. DLCs występują w środowisku najczęściej w postaci mieszanin kongenerów, różniących się między sobą poziomem toksyczności. Aby określić całkowity poziom toksyczności mieszaniny dwóch lub więcej różnych kongenerów, używa się z kolei tzw. równoważnika toksyczności (ang. toxic equivalency, TEQ). Stanowi on sumę iloczynów zawartości masowych poszczególnych składników analizowanej mieszaniny oraz przypisanych im jednostkowych współczynników TEF[7]. Jest to wartość masowa, wyrażana zazwyczaj w pikogramach [pg] lub nanogramach [ng][5].
Otrzymywanie i zastosowanie[edytuj | edytuj kod]

Związki te były produkowane w dużej skali przez Monsanto w Anniston w Alabamie, General Electric oraz kilka innych koncernów chemicznych na świecie od lat trzydziestych XX wieku. W roku 1972 instalacje produkujące te substancje funkcjonowały w Austrii, Francji, Hiszpanii, Japonii, Republice Federalnej Niemiec, Wielkiej Brytanii, Włoszech, USA oraz Związku Radzieckim[8]. Oleje transformatorowe na bazie PCB były sprzedawane w USA pod różnymi nazwami handlowymi m.in.: Aroclor (Monsanto), Pyranol (General Electric). Ocenia się, ze globalnie wyprodukowano około 1,5 miliona ton.
Polichlorowane bifenyle, ze względu na swoje właściwości elektroizolacyjne, stabilność oraz niepalność, były przez około 60 lat wykorzystywane na masową skalę w przemyśle jako izolatory elektryczne oraz ciecze hydrauliczne w kondensatorach i transformatorach. To właśnie wycieki z tych instalacji są jednym ze źródeł PCBs w środowisku. W mniejszym stopniu związki te stosowano także jako smary odporne na wysoką temperaturę, a także jako plastyfikatory do tuszów, farb, klejów, uszczelniaczy i papieru. W przypadkach nieodpowiedniego składowania oraz utylizacji mogły one przeniknąć do środowiska[9].
Do początku lat 70. XX wieku PCBs wchodziły w skład tuszów, którymi były napełniane mikrokapsułki stosowane w papierze samokopiującym[10].
Zagrożenia[edytuj | edytuj kod]
Katastrofy ekologiczne[edytuj | edytuj kod]
PCBs, podobnie jak wszystkie DLCs, mogą dostawać się do środowiska wskutek różnych katastrof ekologicznych, takich jak: awarie fabryk (oraz związane z nimi wycieki różnych substancji), erupcje wulkanów, czy też pożary. Tego typu zdarzenia losowe mogą spowodować emisję bardzo dużej ilości chemikaliów w krótkim czasie. Ponieważ DLCs łatwo rozprzestrzeniają się za pośrednictwem powietrza i wody nawet na bardzo duże odległości, następstwami tego typu katastrof jest często skażenie, które dotyka rejony oddalone nawet o wiele kilometrów od jego źródła[11]. Potwierdzają to podwyższone stężenia DLCs odnotowywane u Inuitów (Eskimosów) oraz niedźwiedzi polarnych zamieszkujących Grenlandię[12].
W 1968 r. w Japonii doszło do masowego zatrucia PCBs i PCDFs, znanego jako tzw. incydent w Yushō. Wskutek spożycia skażonego oleju ryżowego ponad 1900 osób uległo zatruciu. Po ich przebadaniu okazało się, że spożycie wspomnianych ksenobiotyków wyniosło u nich 28–154 ng TEQ/kg/dzień, co przekroczyło przyjętą przez WHO dawkę bezpieczną o ponad 100 000 razy[13]. Najczęstszymi objawami tego zatrucia były: uszkodzenia skóry i oczu, osłabienie odpowiedzi immunologicznej, a u kobiet także rozregulowanie cyklu menstruacyjnego. Niektóre przypadki były jednak dużo poważniejsze. Ostatecznie wskutek tego incydentu śmierć poniosło około 500 osób[14].
Kolejny poważny incydent miał miejsce w 1999 roku w Belgii. W jednej z wytwórni paszy dla zwierząt doszło do jej skażenia PCBs oraz dioksynami na masową skalę. Około 500 ton skażonej karmy trafiło do ponad 2500 ferm. Pomimo iż pierwsze symptomy tej katastrofy (nazywanej również „aferą dioksynową” lub „belgijskim kryzysem dioksynowym”) odnotowano bardzo szybko, opinia publiczna dowiedziała się o niej dopiero po kilku miesiącach. W wyniku braku szybkiej reakcji ze strony belgijskiego rządu, skażony drób oraz wieprzowina dotarły do setek tysięcy odbiorców, wywołując u nich wiele negatywnych skutków zdrowotnych. Po ujawnieniu tego incydentu zwierzęta z ferm, w których wykorzystywano skażoną paszę były poddawane masowym utylizacjom. Spowodowało to ogromne straty finansowe w belgijskiej gospodarce[15][16].
Wpływ na organizm[edytuj | edytuj kod]
Najwięcej PCBs organizm ludzki pobiera wraz z żywnością (ok. 97%), zdecydowanie mniej z powietrzem i wodą. Najbardziej skażone są surowce i produkty pochodzenia morskiego oraz ryby słodkowodne. W żywności pochodzenia zwierzęcego najwięcej PCBs znajduje się w produktach bogatych w tłuszcze (np. tłuste ryby, wątroby). W związku z nagromadzaniem się PCB w kolejnych etapach łańcucha pokarmowego, ryby drapieżne oraz ryby starsze zawierają więcej PCBs niż ryby niedrapieżne i młode. Pochodzenie ryb ma również znaczenie – ryby ze zbiorników zamkniętych bądź z ograniczoną wymianą wody (np. Morze Bałtyckie) zawierają więcej PCBs[17].
Polichlorowane bifenyle mogą powodować zaburzenia funkcjonowania endotelium[18][19], co stanowi z kolei czynnik ryzyka rozwoju wielu chorób układu krążenia, w tym m.in. miażdżycy oraz nadciśnienia tętniczego[20]. U szczurów ekspozycja na PCB-12631 skutkowała przerostem mięśnia sercowego, a także wzrostem stężenia cholesterolu we krwi[21]. Długotrwałe narażenie na dioksyny oraz polichlorowane bifenyle u zwierząt tych było natomiast przyczyną kardiomiopati, a także przewlekłego zapalenia tętnic[22].
Z uwagi na właściwości lipofilowe, PCBs w przypadku kontaktu ze skórą ludzką łatwo przenikają w głąb, przy czym usunięcie zanieczyszczenia przy pomocy mycia wodą z detergentami nie daje zadowalających efektów[10].
Przypisy[edytuj | edytuj kod]
- ↑ Guidelines for the Identification of PCBs and Materials Containing PCBs. United Nations Environment Programme, sierpień 1999. [dostęp 2009-04-25]. (ang.).
- ↑ Rozporządzenia Ministra Gospodarki z dnia 24 czerwca 2002 r. w sprawie wymagań w zakresie wykorzystywania i przemieszczania substancji stwarzających szczególne zagrożenie dla środowiska oraz wykorzystywania i oczyszczania instalacji lub urządzeń, w których były lub są wykorzystywane substancje stwarzające szczególne zagrożenie dla środowiska (Dz.U. z 2002 r. nr 96, poz. 860).
- ↑ Paweł Struciński i inni, Dioksyny a bezpieczeństwo żywności, „Rocznik Państwowego Zakładu Higieny”, 62 (1), 2011, s. 3–17.
- ↑ Uehara R., Nakamura Y., Matsuura N., Kondo N. i inni. Dioxins in human milk and smoking of mothers. „Chemosphere”. 68 (5), s. 915–920, 2007. (ang.).
- ↑ a b Zdzisław Brzeski. Dioksyny i furany w środowisku i ich wpływ na organizm. „Medycyna Ogólna i Nauki o Zdrowiu”. 17 (3), s. 161–164, 2011.
- ↑ Ireneusz Całkosiński, Joanna Rosińczuk-Tonderys, Monika Szopa, Maciej Dobrzyński4 i inni. Zastosowanie wysokich dawek tokoferolu w prewencji i potencjalizacji działania dioksyn w doświadczalnym zapaleniu. „Postępy Higieny i Medycyny Doświadczalnej”. 65, s. 143–157, 2011.
- ↑ Małgorzata Stec, Ewa Kurzeja, Aneta Kościołek, Katarzyna Pawłowska-Góral. Zagrożenia wynikające z narażenia na dioksyny i dioksynopodobne polichlorowane bifenyle. „Problemy Higieny i Epidemiologii”. 93 (4), s. 639–646, 2012.
- ↑ Proceedings of the Subregional Awareness Raising Workshop on Persistent Organic Pollutants (POPs), Bangkok, Thailand. Program Środowiskowy Organizacji Narodów Zjednoczonych, 25–28 listopada 1997. [dostęp 2007-12-11]. (ang.).
- ↑ Grabowska I. Polychlorinated biphenyls (PCBs) in Poland: occurrence, determination and degradation. „Polish Journal of Environmental Studies”. 19 (1), s. 7–13, 2010.
- ↑ a b Masanori Kuratsune, Yoshito Masuda, Polychlorinated Biphenyls in Non-carbon Copy Paper, „Environmental Health Perspectives”, 1, 1972, s. 61–62, ISSN 0091-6765, PMID: 17539088, PMCID: PMC1474878 [dostęp 2022-04-15].
- ↑ Marinković N., Pašalić D., Ferenčak G., Gršković B. i inni. Dioxins and human toxicity. „Archives of Industrial Hygiene and Toxicology”. 61, s. 445–453, 2010. (ang.).
- ↑ Christian Sonne i inni, Xenoendocrine pollutants may reduce size of sexual organs in East Greenland polar bears (Ursus maritimus), „Environmental Science & Technology”, 40, 2006, s. 5668–5674, DOI: 10.1021/es060836n (ang.).
- ↑ Masuda Y., Kuratsune M., Yoshimura H., Hori Y., Okumura M: Yushō, a human disaster caused by PCBs and related compounds. Kyushu University Press, 1996. (ang.).
- ↑ Tsukimori K., Tokunaga S., Shibata S., Uchi H., Nakayama D., Ishimaru T., Nakano H., Wake N., Yoshimura T., Furue M. Long-term effects of polychlorinated biphenyls and dioxins on pregnancy outcomes in women affected by the Yushō incident. „Environmental Health Perspectives”. 116 (5), 2008. (ang.).
- ↑ Bernard A., Broeckaert F., De Poorter G., De Cock A., Hermans C., Sagerman C., Houins G. The Belgian PCB/dioxin incident: analysis of the food chain contamination and health risk evaluation. „Environmental Research”. 88 (1), s. 1–18, 2002. (ang.).
- ↑ Covaci A., Voorspoels S., Schepensa P., Jorensc P., Blustb R., Neelsa H. The Belgian PCB/dioxin crisis – 8 years later: An overview. „Environmental Toxicology and Pharmacology”. 25 (2), s. 164–170, 2008. (ang.).
- ↑ PCB pollution threatens to wipe out killer whales. ScienceDaily. [dostęp 2018-11-06]. (ang.).
- ↑ Hennig B., Meerarani P., Slim R., Toborek M., Daughtery A., Silverstone A.E., Robertson L.W. Proinflammatory properties of coplanar PCBs: in vitro and in vivo evidence. „International Journal of Hygiene and Environmental Health”. 205, s. 95–102, 2002. (ang.).
- ↑ Hennig B., Hammock B.D., Slim R., Toborek M., Saraswathi V., Robertson L.W. PCB-induced oxidative stress in endothelial cells: modulation by nutrients. „Toxicology and Applied Pharmacology”. 181, s. 174–183, 2002. (ang.).
- ↑ Melissa Meyers, Noyan Gokce. Endothelial dysfunction in obesity: etiological role in atherosclerosis. „Current Opinion in Endocrinology, Diabetes and Obesity”. 14 (5), s. 365–369, 2007. DOI: 10.1097/MED.0b013e3282be90a8. PMID: 17940464. (ang.).
- ↑ Lind P.M., Orberg J., Edlund U.B. The dioxin-like pollutant PCB 126 (3,3’,4,4’,5-pentachlorobiphenyl) affects risk factors for cardiovascular disease in female rats. „Toxicology Letters”. 150 (3), s. 293–299, 2004.. (ang.).
- ↑ Micheal P. Jokinen i inni, Increase in cardiovascular pathology in female Sprague-Dawley rats following chronic treatment with 2,3,7,8-tetrachlorodibenzo-p-dioxin and 3,3’,4,4’,5-pentachlorobiphenyl, „Cardiovascular Toxicology”, 3 (4), 2003, s. 299–310, DOI: 10.1385/CT:3:4:299, PMID: 14734827 (ang.).
