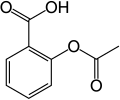
Kwas acetylosalicylowy
| |||||||||||||||||||||||||||||
 Krystaliczny kwas acetylosalicylowy | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny |
C9H8O4 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
C6H4(OCOCH3)COOH | ||||||||||||||||||||||||||||
| Masa molowa |
180,16 g/mol | ||||||||||||||||||||||||||||
| Wygląd |
białe kryształy o kwaśnym smaku[1] | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||
| PubChem |
{{{nazwa}}}, [w:] PubChem, United States National Library of Medicine, CID: (ang.). | ||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||
| ATC |
A01AD05, B01AC06, C07FX02 C07FX03 C07FX04 C10BX, M01BA, N02BA01 | ||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
Kwas acetylosalicylowy (łac. acidum acetylsalicylicum), potocznie aspiryna (od niem. Aspirin) – organiczny związek chemiczny, acetylowa pochodna kwasu salicylowego, popularny środek o działaniu przeciwbólowym, przeciwgorączkowym i przeciwzapalnym[1] oraz, przy długotrwałym stosowaniu, przeciwzakrzepowym. Jest składnikiem wielu leków złożonych. Jest też stosowany w uprawie rolnej do stymulowania odporności u roślin[6].
Otrzymywanie
Kwas acetylosalicylowy otrzymuje się w reakcji kwasu salicylowego z bezwodnikiem octowym w obecności kwasu siarkowego lub fosforowego jako katalizatora[7]:
Działanie
Kwas acetylosalicylowy jest inhibitorem cyklooksygenazy i działa (nieodwracalnie) poprzez acetylację jej centrum katalitycznego. Enzym ten katalizuje reakcje syntezy prostaglandyn, które są mediatorami reakcji zapalnej. Aspiryna hamuje również powstawanie prostacyklin. W ten sposób kwas acetylosalicylowy wywiera działanie przeciwbólowe, przeciwgorączkowe i przeciwzapalne i jest zaliczany do grupy niesteroidowych leków przeciwzapalnych (NLPZ). Mimo że jest tak starym lekiem, w większości krajów jest nadal najczęściej stosowanym specyfikiem przeciwbólowym i przeciwgorączkowym (obok paracetamolu). WHO uznało kwas acetylosalicylowy za jeden z najlepszych środków do stosowania na pierwszym szczeblu przeciwbólowej drabiny analgetycznej, w leczeniu lekkich i umiarkowanych bólów towarzyszących chorobom nowotworowym[potrzebny przypis].
Inną ważną cechą kwasu acetylosalicylowego wykorzystywaną w lecznictwie jest zdolność hamowania cyklooksygenazy w płytkach krwi, w których jest ona odpowiedzialna za produkcję tromboksanu. W ten sposób aspiryna hamuje zdolność płytek krwi do agregacji i tworzenia skrzepów. W przeciwieństwie do innych komórek organizmu, płytki krwi nie mają możliwości regulacji stężenia i aktywności cyklooksygenazy, raz zahamowane pozostają nieaktywne aż do ich lizy (około siedmiu dni)[potrzebny przypis].
Małe dawki kwasu acetylosalicylowego (81–325 mg/dobę) stosowane są w profilaktyce udaru mózgu i zawału mięśnia sercowego[8][9][10].
W 2007 roku opublikowano badanie, oparte na retrospektywnej obserwacji 79 439 kobiet w badaniu Nurse Health Study, w którym oceniono umieralność wśród kobiet przyjmujących i nieprzyjmujących ASA. W trakcie 24-letniej obserwacji wykazano zmniejszenie ogólnej umieralności o 25%. Umieralność z przyczyn sercowo-naczyniowych była zmniejszona o 38% już po 1 roku zażywania ASA, natomiast umieralność z powodu nowotworów była zmniejszona o 12% i zaobserwowana została po 10-letnim okresie stosowania leku. Korzyści te były obserwowane w grupie przyjmujących poniżej 14 standardowych dawek kwasu acetylosalicylowego na miesiąc[11]. Jednocześnie w innym badaniu[12] wykazano, że nie ma obecnie żadnych przesłanek, aby w długotrwałym stosowaniu aspiryny stosować dawki większe niż 75–81 miligramów. Kwas salicylowy powoduje rozluźnienie zewnętrznej (rogowej)warstwy skóry i ułatwia wchłanianie kortykosteroidu stąd też zastosowanie w lekach miejscowych do leczenia łuszczycy[13].
Kwas acetylosalicylowy stosowany w dawkach dobowych nie przekraczających 1-2 gramów hamuje nerkowe wydalanie kwasu moczowego, co może prowadzić do zwiększonej częstości napadów dny moczanowej wśród osób chorujących na tę chorobę[8]. Dotyczy to także bardzo małych dawek, poniżej 325 mg, które są powszechnie stosowane w celu zapobiegania zawałowi mięśnia sercowego lub udarowi niedokrwiennemu mózgu. Paradoksalnie, w dawkach bardzo wysokich, tj. 5-6 gramów, kwas acetylosalicylowy zwiększa wydalanie kwasu moczowego[14]. Zjawisko to tłumaczy się wpływem blokującym małych dawek jedynie na mechanizm wydzielania kwasu moczowego do przesączu pierwotnego, natomiast wpływem dużych dawek na proces zarówno wydzielania, jak i wchłaniania zwrotnego, przy czym blokada wchłaniania zwrotnego przeważa, co skutkuje nadmiernym wydalaniem kwasu moczowego[14].
Działania niepożądane
Regularne zażywanie aspiryny blisko dwukrotnie zwiększa ryzyko wystąpienia mokrej postaci zwyrodnienia plamki żółtej (AMD), niezależnie od faktu bycia palaczem czy stwierdzonej choroby układu krwionośnego, które same w sobie są czynnikami sprzyjającymi rozwinięciu AMD[15][16].
Przeciwwskazania
Leki zawierające w swym składzie kwas acetylosalicylowy są przeciwwskazane dla osób cierpiących na chorobę wrzodową żołądka lub dwunastnicy. Aspiryna, poprzez zahamowanie produkcji prostaglandyn, przyczynia się do zmniejszenia wydzielania przez ściany żołądka ochronnego śluzu. Poza tym wywiera bezpośrednie działanie podrażniające na błony śluzowe przewodu pokarmowego[potrzebny przypis].
Kwas acetylosalicylowy nie powinien być stosowany przez kobiety w ciąży – badania wykazały korelację między jego zażywaniem przez matki a występowaniem rozszczepu podniebienia, wad serca i mniejszej masy urodzeniowej u noworodków. Salicylany zażywane w ciąży zwiększają też ryzyko powikłań okołoporodowych, gdyż zaburzają syntezę pochodnych kwasu arachidonowego[potrzebny przypis].
Kwasu acetylosalicylowego nie należy podawać małym dzieciom oraz młodzieży w leczeniu objawowym grypy, przeziębienia i innych chorób wirusowych, ponieważ istnieją podejrzenia, że może on powodować wystąpienie potencjalnie śmiertelnego zespołu Reye’a[17][18][19].
Leki zawierające acetylosalicylany (wszystkie piryny) nie powinny być też stosowane przez osoby ze skazami krwotocznymi, jak hemofilia lub choroba von Willebranda, gdyż obniżają krzepliwość krwi[potrzebny przypis].
Kwas acetylosalicylowy nie powinien być stosowany przez osoby cierpiące na astmę, ponieważ może wywołać napad duszności, tzw. astmę aspirynową. Nie może być stosowany u osób chorych na cukrzycę, gdyż nasila działanie leków przeciwcukrzycowych i może dojść do znacznego obniżenia poziomu glukozy we krwi i zasłabnięcia.
U niektórych osób odstawia się kwas acetylosalicylowy na 7–10 dni przed zabiegiem operacyjnym, aby zdolność płytek do agregacji wróciła do stanu pierwotnego, czyli łatwego krzepnięcia (podczas podejmowania decyzji o odstawieniu należy wziąć pod uwagę prawdopodobieństwo krwawienia podczas zabiegu i zagrożenia związane z zaprzestaniem przyjmowania tego leku, na przykład zwiększone ryzyko zawału serca).
Dawkowanie
Dawkowanie zależy od wskazania, zalecana dawka to najmniejsza, która przynosi pozytywny skutek. Typowa dawka dobowa to 2,5 g w dawkach 0,5–1 g podawanych co 4–8 godzin; nie należy przekraczać 4 g na dobę. W niektórych chorobach dawki są większe, na przykład w gorączce reumatycznej zaleca się 7–8 g na dobę. Lek można przyjmować bez konsultacji z lekarzem najdłużej przez trzy dni[20][21][22].
Preparaty
Chociaż nazwa Aspirin jest zastrzeżona w Polsce (i innych krajach, oprócz Stanów Zjednoczonych, Wielkiej Brytanii, Francji i Rosji) dla kwasu acetylosalicylowego produkcji firmy Bayer, potocznie aspiryną nazywa się wszystkie farmaceutyki zawierające kwas acetylosalicylowy jako substancję czynną[potrzebny przypis].
Nazwa handlowa polskiego leku będącego czystym kwasem acetylosalicylowym to Polopiryna S (pojawiły się też inne, na przykład Cardiopirin, Hascopiryn). W sprzedaży są także specyfiki (Ascalcin Plus, Ascodan, Asprocol, Calcipiryna, Coffepirine, Etopiryna, Kopiryna), w których występuje on z różnymi dodatkami. Popularne niegdyś „tabletki od bólu głowy z krzyżykiem” (ułatwiającym dzielenie) zostały wycofane ze sprzedaży, ponieważ dodatkowo zawierały szkodliwą fenacetynę[potrzebny przypis].
Na rynku znajduje się bardzo wiele preparatów z kwasem acetylosalicylowym, w różnych postaciach: tabletki, tabletki musujące oraz tabletki dojelitowe. Przyjmuje się, że najlepszą formą są tabletki dojelitowe (np. Bestpirin, Polocard, Proficar), posiadające specjalną otoczkę odporną na kwasy znajdujące się w żołądku – lek uwalniany jest dopiero w jelicie cienkim, co częściowo chroni błonę śluzową żołądka (lek będzie przedostawał się do żołądka również drogą krwionośną, dlatego będzie mógł powodować chorobę wrzodową żołądka i dwunastnicy)[potrzebny przypis].
Leki, w których kwas acetylosalicylowy jest substancją czynną, są przeważnie dostępne bez recepty[potrzebny przypis].
Historia
Kwas salicylowy zawarty w korze wierzby znany był ludzkości od zarania dziejów: właściwości kory wierzbowej opisują po raz pierwszy egipskie zwoje z okresu około 1550 roku p.n.e., była ona też środkiem leczniczym zalecanym przez na przykład Hipokratesa, Aulusa Corneliusa Celsusa, Pliniusza Starszego, czy Pedaniosa Dioskurydesa[potrzebny przypis]. W latach 1828–1829 niemiecki profesor farmacji Johann Buchner[23] i Francuz Pierre-Joseph Leroux[24][25] wyizolowali z kory wierzby salicynę (glikozyd fenolowy będący połączeniem saligeniny (alkoholu salicylowego) z glukozą). W roku 1838 Włoch Rafaelle Piria opracował metodę hydrolizy salicyny i utlenienia saligeniny do kwasu salicylowego[25].
Kwas acetylosalicylowy po raz pierwszy otrzymał w roku 1853 francuski chemik Charles Frédéric Gerhardt[26], jednak nie zdołał uzyskać go w czystej formie ani nie rozwiązał jego struktury[27][25]. W roku 1859 H. von Gilm otrzymał acetylową pochodną kwasu salicylowego w formie krystalicznej[28]. W roku 1869 A. Schröder, A. Prinzhorn i K. Kraut powtórzyli procedury acetylowania Gerhardta (z salicylanu sodu) i von Gilma (z kwasu salicylowego), ustalając, że produktem obu reakcji jest kwas acetylosalicylowy[29].
Substancję tę, w formie nadającej się do stosowania farmaceutycznego, zsyntetyzował w roku 1897 Felix Hoffmann, niemiecki chemik pracujący wówczas dla przedsiębiorstwa chemicznego Friedrich Bayer & Co. Sprzedawana pod nazwą handlową Aspirin, była pierwszym lekiem uzyskanym w sposób syntetyczny, a nie wyizolowanym z surowców występujących w przyrodzie. Syntezę aspiryny uważa się za początek przemysłu farmaceutycznego. W 1949 roku w piśmie Pharmazie ukazała się publikacja autorstwa Arthura Eichengrüna, innego z badaczy pracujących w firmie Bayer, który twierdził, że to on był autorem pomysłu syntezy aspiryny i powierzył Hoffmannowi jej wykonanie[30].
Etymologia nazwy
Potoczna nazwa „aspiryna” (spolszczenie niemieckiego Aspirin) powstała jako połączenie elementów[potrzebny przypis]:
- a – od acetylosalicylowy (kwas)
- spir – od dawnej nazwy rośliny (Spirea ulmaria, współcześnie Filipendula ulmaria – wiązówka błotna), z której początkowo uzyskiwano lek przeciwbólowy
- -in – dawniej stosowana końcówka nazw leków przeciwbólowych.
Przypisy
- ↑ a b Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 208, ISBN 83-7183-240-0.
- ↑ a b c CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, s. 3-8, 5-100, 5-156, ISBN 978-1-4822-0867-2 (ang.).
- ↑ a b c d Kwas acetylosalicylowy, międzynarodowa karta bezpieczeństwa chemicznego, Międzynarodowa Organizacja Pracy [dostęp 2016-03-15] (pol. • ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiePubChemBŁĄD PRZYPISÓW - ↑ a b Kwas acetylosalicylowy (nr A5376) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2016-03-15]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Acetyl salicylic acid (Aspirin) and salicylic acid induce multiple stress tolerance in bean and tomato plants | SpringerLink [online], link.springer.com [dostęp 2018-04-07] (ang.).
- ↑ John A. Olmsted III. Synthesis of Aspirin: A General Chemistry Experiment. „Journal of Chemical Education”. 75, s. 1262–1263, 1998. DOI: 10.1021/ed075p1261.
- ↑ a b Yuqing Zhang i inni, Low-dose aspirin use and recurrent gout attacks, „Annals of the rheumatic diseases”, 73 (2), 2014, s. 385–390, DOI: 10.1136/annrheumdis-2012-202589, ISSN 0003-4967, PMID: 23345599, PMCID: PMC3902644 [dostęp 2017-12-14].
- ↑ Shuai Tan i inni, Clopidogrel and Aspirin versus Aspirin Alone for Stroke Prevention: A Meta-Analysis, „PLoS ONE”, 10 (8), 2015, DOI: 10.1371/journal.pone.0135372, ISSN 1932-6203, PMID: 26270530, PMCID: PMC4536208 [dostęp 2017-12-14].
- ↑ Samuel Tchwenko, Eleanor Fleming, Geraldine S. Perry, Aspirin Use for the Primary Prevention of Myocardial Infarction Among Men in North Carolina, 2013, „Preventing Chronic Disease”, 12, 2015, DOI: 10.5888/pcd12.150342, ISSN 1545-1151, PMID: 26583574, PMCID: PMC4655480 [dostęp 2017-12-14].
- ↑ Andrew T. Chan, JoAnn E. Manson, Diane Feskanich, Meir J. Stampfer i inni. Long-term Aspirin Use and Mortality in Women. „Arch Intern Med.”. 167 (6), s. 562–572, 2007.
- ↑ Charles L. Campbell, Susan Smyth, Gilles Montalescot, Steven R. Steinhubl. Aspirin Dose for the Prevention of Cardiovascular Disease. „JAMA”. 297 (18), s. 2018–2024, 2007. DOI: 10.1001/jama.297.18.2018.
- ↑ Salbetan | Centrum Informacji o Leku [online], www.leki-informacje.pl [dostęp 2017-11-24] (pol.).
- ↑ a b T’Sai Fan Yü, Alexander B. Gutman, Study of the paradoxical effects of salicylate in low, intermediate and high dosage on the renal mechanisms for excretion of urate in man., „Journal of Clinical Investigation”, 38 (8), 1959, s. 1298–1315, DOI: 10.1172/JCI103905, ISSN 0021-9738, PMID: 13673086, PMCID: PMC442084 [dostęp 2017-12-14].
- ↑ Aspirin And AMD. amd.org, 2011-10. [dostęp 2015-02-15].
- ↑ G. Liew, P. Mitchell, T.Y. Wong, E. Rochtchina i inni. The association of aspirin use with age-related macular degeneration. „JAMA Intern Med”. 173 (4), s. 258–264, 2013. DOI: 10.1001/jamainternmed.2013.1583. PMID: 23337937.
- ↑ Neurologia Merrita. Lewis Rowland (red.). Wrocław: Elsevier Urban & Partner, 2008, s. 266. ISBN 978-83-60290-29-3.
- ↑ Ninove, L., Daniel, L., Gallou, J., Cougard, P.-A. i inni. Fatal case of Reye’s syndrome associated with H3N2 influenza virus infection and salicylate intake in a 12-year-old patient. „Clinical Microbiology and Infection”. 17 (1), s. 95–97, 2011. DOI: 10.1111/j.1469-0691.2010.03196.x.
- ↑
 Menen E. Mund, Christoph Gyo, Dörthe Brüggmann, David Quarcoo i inni. Acetylsalicylic acid as a potential pediatric health hazard: legislative aspects concerning accidental intoxications in the European Union. „Journal of Occupational Medicine and Toxicology”. 11 (1), s. 32, 2016. DOI: 10.1186/s12995-016-0118-5.
Menen E. Mund, Christoph Gyo, Dörthe Brüggmann, David Quarcoo i inni. Acetylsalicylic acid as a potential pediatric health hazard: legislative aspects concerning accidental intoxications in the European Union. „Journal of Occupational Medicine and Toxicology”. 11 (1), s. 32, 2016. DOI: 10.1186/s12995-016-0118-5.
- ↑ Polopiryna S – Acidum acetylsalicylicum – zastosowanie i działanie lecznicze. DOZ.pl. [dostęp 2012-04-09].
- ↑ Aspirin – Acidum acetylsalicylicum – zastosowanie i działanie lecznicze. DOZ.pl. [dostęp 2012-04-09].
- ↑ Kwas acetylosalicylowy (opis profesjonalny). Medycyna praktyczna – baza leków. [dostęp 2012-04-09].
- ↑ Johann Andreas Buchner. W: Allgemeine Deutsche Biographie (ADB). T. 3. Lipsk: Duncker & Humblot, 1876, s. 487.
- ↑ Dominique Kassel: Des pharmaciens dans leur siècle, le XIXe. Ordre national des pharmaciens, 2002. [dostęp 2011-02-15]. (fr.).
- ↑ a b c O. Lafont. From the willow to aspirin. „Rev Hist Pharm (Paris)”. 55 (354), s. 209–216, 2007. PMID: 18175528.
- ↑ C. Gerhardt. Untersuchungen über die wasserfreien organischen Säuren. „Annalen der Chemie und Pharmacie”. 87, s. 149–179, 1853. DOI: 10.1002/jlac.18530870107.
- ↑ K.C. Nicolaou, Tamsyn Montagnon: Molecules that changed the world: a brief history of the art and science of synthesis and its impact on society. Wiley-VCH, 2008, s. 24. ISBN 978-3-527-30983-2.
- ↑ H. von Gilm. Acetylderivate der Phloretin- und Salicylsäure. „Annalen der Chemie und Pharmacie”. 112 (2), s. 180–185, 1859. DOI: 10.1002/jlac.18591120207.
- ↑ Ad. Schröder, Ad. Prinzhorn, K. Kraut. Uber Salicylverbindungen. „Annalen der Chemie und Pharmacie”. 150 (1), s. 1–20, 1869. DOI: 10.1002/jlac.18691500102.
- ↑ W. Sneader, F. Hoffmann, A. Eichengrün. The discovery of aspirin: a reappraisal. „BMJ”. 321 (7276). s. 1591–1594. PMID: 11124191. PMCID: PMC1119266.
Linki zewnętrzne
- Karol Kacprzak: Otrzymywanie kwasu acetylosalicylowego – aspiryny. Wydział Chemii UAM. [dostęp 2016-04-01].