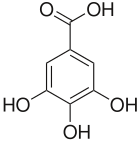
Kwas galusowy
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C7H6O5 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
C6H2(OH)3COOH | ||||||||||||||||||||||||||||||||
| Masa molowa |
170,12 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd |
białe, żółtobiałe kryształy | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS |
149-91-7 (bezwodny) | ||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
Kwas galusowy, kwas 3,4,5-trihydroksybenzoesowy – organiczny związek chemiczny z grupy kwasów fenolowych, trihydroksylowa pochodna kwasu benzoesowego. Bezbarwne, rozpuszczalne w wodzie kryształy. Kompleksuje jony żelaza(III) (Fe3+
), dając związki o intensywnie ciemnym zabarwieniu.
Występowanie[edytuj | edytuj kod]
Kwas galusowy występuje w wielu roślinach zarówno w stanie wolnym, jak również w postaci galotaniny. Kwas ten zawiera na przykład ziele żurawki, jak również liść i kora oczaru[6]. W roślinach z rodzaju brezylka (Caesalpinia) oraz w galasach występuje w postaci kwasu galusowo-taninowego. Kwas galusowy jest składnikiem liści herbaty. Można go wykryć w herbacie za pomocą roztworu chlorku żelaza(III) (reakcja charakterystyczna dla fenoli – roztwór przyjmuje charakterystyczne granatowo-fioletowe zabarwienie).
Otrzymywanie[edytuj | edytuj kod]
Kwas galusowy jest otrzymywany z galasów przez ekstrakcję. Jest wykorzystywany m.in. do wyrobu barwników i atramentów. Znane są „atramenty galusowe” zawierające oprócz niebieskiego barwnika (dla uwidocznienia pisma) także prawie bezbarwny galusan żelaza(II). W wyniku utlenienia tlenem z powietrza przechodzi on w czarny związek żelaza(III), uwidaczniając w ten sposób wcześniej naniesiony tekst. Dermatol (zasadowy galusan bizmutu) stosowany jest w medycynie i kosmetyce jako środek ściągający i wysuszający wydzieliny. Estry kwasu galusowego są stosowane w przemyśle jako przeciwutleniacze przeciwdziałające jełczeniu tłuszczów jadalnych.
Właściwości biologiczne[edytuj | edytuj kod]
Wykazuje zdolność blokowania związków rakotwórczych powstających w cyklu przemian metabolicznych niektórych kancerogenów oraz wykazuje właściwości ściągające, antyseptyczne i przeciwpotne[7].
Zastosowanie[edytuj | edytuj kod]
Kwas galusowy czasami wykorzystuje się w pirotechnice, ponieważ zmieszany z silnymi utleniaczami np. chloranami (głównie potasu i sodu) tworzy mieszaninę zdolną przy odpowiednich warunkach do gwałtownego palenia[8].
Od wieku XVII do początku XIX wykorzystywany był do odczytywania palimpsestów[9]. W XIX wieku zastąpił go w tym żelazicyjanek potasu.
Przypisy[edytuj | edytuj kod]
- ↑ a b c Haynes 2014 ↓, s. 3-530.
- ↑ Haynes 2014 ↓, s. 5-99.
- ↑ a b c Haynes 2014 ↓, s. 5-188.
- ↑ a b Kwas galusowy (nr G7384) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2016-04-11]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Kwas galusowy (nr G7384) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2016-04-11]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Antyoksydanty w ziołach. « Medycyna dawna i współczesna [online], rozanski.li [dostęp 2017-11-24] (pol.).
- ↑
 Anna Parus. Przeciwutleniające i farmakologiczne właściwości kwasów fenolowych. „Postępy Fitoterapii”. 1/2013. s. 48–53.
Anna Parus. Przeciwutleniające i farmakologiczne właściwości kwasów fenolowych. „Postępy Fitoterapii”. 1/2013. s. 48–53.
- ↑ The Chemistry of Fireworks: Bangs, Crackles & Whistles. [dostęp 2016-07-05]. (ang.).
- ↑ Encyclopedia of Textual Criticism. [dostęp 2016-04-11]. (ang.).
Bibliografia[edytuj | edytuj kod]
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 95, Boca Raton: CRC Press, 2014, ISBN 978-1-4822-0867-2 (ang.).
- Reagent Chemicals. Specifications and Procedures. American Chemical Society Committee on Analytical Reagents. Wyd. 10. Washington, D.C., New York: American Chemical Society, Oxford University Press, 2006. ISBN 0-8412-3945-2. OCLC 58842975.