Szczeciniec większy
| Thryonomys swinderianus[1] | |||
| (Temminck, 1827) | |||
 szczeciniec większy | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Nadgromada | |||
| Gromada | |||
| Podgromada | |||
| Infragromada | |||
| Rząd | |||
| Podrząd | |||
| Infrarząd | |||
| Parvordo | |||
| Nadrodzina | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek |
szczeciniec większy | ||
| Synonimy | |||
| |||
| Kategoria zagrożenia (CKGZ)[10] | |||
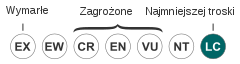 | |||
Szczeciniec większy[11] dawn. szczeciniec[12] (Thryonomys swinderianus) – gatunek afrykańskiego gryzonia z rodziny szczecińcowatych (Thryonomyidae) z rodzaju szczeciniec (Thryonomys)[13][11]. Jest drugim pod względem wielkości po jeżozwierzu afrykańskim gryzoniem żyjącym współcześnie w Afryce[14]. W wielu krajach Afryki Środkowej prowadzi się jego intensywną hodowlę ukierunkowaną na produkcję mięsa, promowaną przez wiele rządów[15] i instytucji międzynarodowych – między innymi przez FAO – jako zapewniającą źródło wysokobiałkowej żywności dla ubogich państw afrykańskich[16][17][18].
Systematyka[edytuj | edytuj kod]
Szczeciniec większy należy do parworzędu Phiomorpha – afrykańskiego odpowiednika taksonu Caviomorpha grupującego południowoamerykańskie gryzonie infrarzędu jeżozwierzokształtne (Hystricognathi)[19]. Do rodzaju szczeciniec (Thryonomys) należy także szczeciniec mniejszy (Thryonomys gregorianus)[11].
Nazewnictwo[edytuj | edytuj kod]

Nazewnictwo łacińskie[edytuj | edytuj kod]
Nazwa rodzajowa Thryonomys pochodzi od greckich słów: thryon (Θρύον) oznaczającego trzcinę oraz mys (μυς) znaczącego „mysz” i jest prawdopodobnie aluzją do życia wśród trzcin[21]. W literaturze spotykana jest także synonimiczna nazwa gatunku – Aulacodus swinderianus.
Nazewnictwo narodowe[edytuj | edytuj kod]
W anglojęzycznych krajach Afryki funkcjonują nazwy: Marsh cane rat[22], Great cane rat, Greater cane rat, Grasscutter lub Cutting grass[2]. Dwie ostatnie nawiązują do specyficznego sposobu odgryzania łodyg i wyjadania tylko najsmaczniejszych części. Pozostałe fragmenty roślin zostają na ziemi niczym po skoszeniu kosiarką[21]. Inna nazwa: Reed-rat[23] nawiązuje do żerowania w trzcinach (ang. reed = trzcina). We francuskojęzycznych krajach Afryki używa się określenia Le grand aulacode[24].
W wydanej w 2015 roku przez Muzeum i Instytut Zoologii Polskiej Akademii Nauk publikacji „Polskie nazewnictwo ssaków świata” gatunkowi nadano polską nazwę szczeciniec większy, rezerwując nazwę szczeciniec dla rodzaju tych gryzoni[11].

Morfologia[edytuj | edytuj kod]
Szczeciniec większy jest gryzoniem o masywnej sylwetce. Długość ciała wynosi 40–60 cm, zaś samego ogona: 20–25 cm[22]. Inne źródła[2] podają wymiary ciała 25–70 cm (średnio 48 cm).
Przy mocnej budowie ciała głowa jest stosunkowo mała. Nos jest owalny[2]. Uszy są małe, krótkie i szerokie. Pokrywa je w całości sierść. Szorstka sierść tułowia ma barwę żółto-brązową przechodzącą szaro-brązową. Pysk, podbródek i gardło są zazwyczaj białe. Niżej w kierunku brzucha sierść przechodzi w brąz nakrapiany białym kolorem. Drogą mutacji genetycznych otrzymano osobniki o jednolitych barwach: czarnej, pomarańczowo-beżowej czy białej[2]. Skóra szczecińca większego jest biała, delikatna, podatna na uszkodzenia, lecz łatwo się gojąca. Ciemnobrązowy ogon zwęża się ku końcowi, pokrywa go krótka szczeciniasta sierść. Przy łapaniu zwierzęcia za ogon łatwo go urwać, jest on kruchy. U dorosłych osobników obszary genitalne mają kolor pomarańczowy. Łapy są mocne, stopy wypłaszczone. Przednie, nieco mniejsze od tylnych, mają dobrze ukształtowane trzy środkowe palce. Pierwszy i piąty są zredukowane[2]. Tylne łapy są wyposażone w cztery mocne palce, zaś piąty jest mały. Pazury są mocne, proste[21].
W zależności od badanej populacji podaje się różne przeciętne przedziały masy dorosłych osobników: od 4300 g do 6832 g[25] (według van der Merve[21] 3,4–6,5 kg). Przeciętna waga samic wynosi 3 kg, a samców 4,5 kg[26], a maksymalna waga samców może dochodzić do 10 kg[17]. Opara[2] określa maksymalną masę samców na 12 kg.

| wymiary | samce | samice |
|---|---|---|
| Długość ciała w mm | 670–792 | 654–670 |
| Długość ogona w mm | 180–192 | 165–195 |
| Waga w kg | 5–6,5 | 3,4–3,8 |
Szczeciniec większy rodzi się z czterema siekaczami[14], których nie wymienia w czasie dojrzewania. Zęby są w kolorze żółtym lub pomarańczowym. Jak u wszystkich gryzoni, siekacze rosną przez całe życie[2], co powoduje konieczność ciągłego ich ścierania. Uzębienie jest uznawane za raczej kruche[22]. Wzór zębowy: [27], lub jak podają inne źródła[14]:
Dymorfizm płciowy[edytuj | edytuj kod]
W celu rozróżniania płci osobników hodowcy najczęściej porównują długość ciała lub wielkość czaszki[28], lub odległość między zewnętrznymi narządami płciowymi a odbytem[15]. Odległość u nowo narodzonych samców wynosi 10 mm, a u samic poniżej 5 mm. U dorosłych osobników: samce 38 mm, a samice 12 mm[22]. Inne źródła[15] podają nieco inne wymiary – samce 20–30 mm, samice 7 mm – ale zasada pozostaje potwierdzona. Charakterystyczną cechą samców jest ciemnobrązowe wybarwienie dookoła strefy genitalnej[2]. Hodowcy rozróżniają płeć także po charakterystycznych dźwiękach wydawanych przez osobniki obu płci. Sutki samic, rozmieszczone w rzędach po 3 sztuki po bokach, ujawniają się w okolicy terminu porodu[2].
Tryb życia[edytuj | edytuj kod]
Na wolności T. swinderianus prowadzi nocny tryb życia[21]. Dobrze biega, co pozwala mu na szybką ucieczkę w czasie zagrożenia, potrafi także pływać. Nie skacze na wysokość większą niż 1 metr[2].
Cykl życiowy[edytuj | edytuj kod]
Dojrzałość płciową samice osiągają w wieku 5 miesięcy, zaś samce w wieku 6 miesięcy[2]. Cykl jajeczkowania u samic nie jest dokładnie udokumentowany – wiadomo tylko, że trwa przeciętnie przez 6,62 dnia. Zoolodzy[29][2] zaznaczają, że owulacja u T. swinderianus ma charakter spontaniczny – jak u pozostałych jeżozwierzowców (Hystricomorpha) i jest indukowana obecnością samca[30]. Samica może rodzić przez cały rok, a aktywność seksualna oraz cykl są zmienne. Samica rodzi po raz pierwszy po osiągnięciu wieku 12–18 miesięcy[24]. Najkrótsza odnotowana ciąża trwała 148 dni, a najdłuższa 170 dni[30], więc możliwe jest zajście przez samicę w ciążę dwukrotnie w ciągu roku. W badanej populacji[24] odnotowano liczniejsze porody w okresach styczeń-marzec oraz lipiec-sierpień.
Przez ostatnie 3 dni przed porodem samica chodzi tylko na tylnych łapach[30]. W takiej pozycji dokonuje się także poród. Trwa on około 40–57 minut. Czekając na pojawienie się kolejnego dziecka, samica zjada łożysko. Zwykle rodzi 2–6 młodych[14] (przeciętnie 4[30]), choć stwierdzono także liczniejsze mioty – w przedziale 6–8 sztuk. Młode bezpośrednio po urodzeniu podążają za matką[17]. Są pokryte futrem, mają otwarte oczy i ważą 70–130 g. Pod opieką matki pozostają przez pierwszy miesiąc życia. Po 5 miesiącach życia osiągają wagę około 1 kg.
Długość życia[edytuj | edytuj kod]
Przeciętna długość życia szczecińca większego w niewoli wynosi 7–9 lat. Maksymalnie 12 lat[2]. Niektóre źródła podają krótszy okres – 4 lata[31].
Struktura społeczna[edytuj | edytuj kod]
Są z natury samotnikami, choć w okresach rozrodu, które często przypadają na porę deszczową, łączą się w niewielkie grupy[2]. Na wolności w tym okresie stado składa się zazwyczaj z samca i dwóch lub trzech samic[32]. Grupa liczy zazwyczaj do dwunastu osobników[21]. W okresach suchych samce oddzielają się od stada i wiodą samotniczy tryb życia[2].
Komunikacja[edytuj | edytuj kod]
Szczecińce większe komunikują się między sobą za pomocą rozbudowanego systemu dźwięków. Badacze wyodrębnili pięć kategorii dźwięków głosowych, a także dźwięk tupania tylnymi łapami i zgrzytania zębami. Niektóre z sygnałów są stosowane przez te gryzonie dość powszechnie w zróżnicowanych sytuacjach, ale część z nich łatwo skojarzyć z konkretnymi zachowaniami. Między innymi piski wydawane przez samice w kierunku swych dzieci wyrażają troskę o bezpieczeństwo i przywołują młode do powrotu z oddalenia. Inne dźwięki są używane przez młode w wieku od jednego do kilku tygodni życia, te gdy się zgubią i wzywają pomocy w odnalezieniu drogi. Jeszcze inne dźwięki są wydawane przez dominujące samce w celu odstraszenia rywala lub wroga[33].
W sytuacji zagrożenia T. swinderianus podnosi alarm charakterystycznym gwizdem i tupotem tylnymi łapami. Na ten znak stado ucieka, by powrócić po chwili w celu sprawdzenia, czy zagrożenie minęło[34]. Zgrzytanie zębami nie ma pierwotnej roli komunikacyjnej, ale jest związane z żerowaniem. Pełni wtórną funkcję jako znak, który pozwala na zsynchronizowanie pory jedzenia w stadzie. Wydawane odgłosy pozwalają także na lokalizowanie się wzajemnie zwierząt podczas nocnej aktywności[33].
Drugim istotnym zmysłem pomagającym szczecińcom większym w komunikacji jest dobrze rozwinięty węch[22].
Rozmieszczenie geograficzne[edytuj | edytuj kod]
Gatunek pospolicie występuje w Afryce na południe od Sahary. Zestawienie informacji o rozmieszczeniu geograficznym ma wiele białych plam. Wynika to z braku udokumentowanych opisów występowania. Potwierdzone informacje mówią o zamieszkiwaniu gatunku od Senegalu, Gambii, Gwinei przez północne tereny Konga, południe Sudanu oraz we wschodniej Afryce: Uganda i Kenia, południe Tanzanii, Zambia, Malawi, Zimbabwe południowy Mozambik, po południowo-wschodnie krańce Afryki Południowej[10].
Ślady kopalne występowania Thryonomys[edytuj | edytuj kod]
Przodkowie gatunków rodzaju Thryonomys mieszkali w rejonie środkowej Sahary w epoce plejstocenu[35]. Poszczególni badacze wskazywali na różne lokalizacje i nazwy: Alfred Romer i Paul Nesbitt pisali o śladach T. logani znalezionych około 800 km od rzeki Niger[35], a Dorothy Bate opisywała ślady T. arkelli odnalezione w Sudanie[9]. Brakuje jednak badań, czy byli to bezpośredni przodkowie T. swinderianus, czy też gatunki spokrewnione.
Ekologia[edytuj | edytuj kod]
T. swinderianus jest roślinożercą o szerokim spektrum składników wyżywienia. Motorem trawienia jest fermentacja bakteryjna w kątnicy[21]. Podstawowym elementem diety są trawy o wysokiej zawartości włókna[22], zasobne w wilgoć i węglowodany[24]. Zwierzę żywi się liśmi i korą, toleruje glikozydy zawarte w zielonej kukurydzy, sorgo i manioku[24]. Gryzoń chętnie zjada opadłe owoce, orzechy[36]. Szczeciniec większy żeruje w sposób selektywny. Łodygi wybranych traw ścina siekaczami w taki sposób, by zjeść tylko interesujące go smakowite części. Resztę łodygi pozostawia na ziemi[24]. Kiedy jednak zachodzi konieczność, potrafi dość szybko zaadaptować się do zmienionej diety. T. swinderianus wykazuje także skłonność do koprofagii[21]. Kanibalizm jest przez badaczy wykluczany[25].
Zazwyczaj w skład menu wchodzą[28]: maniok jadalny, Megathyrsus maximus, Pennisetum purpureum, Heteropogon contortus, banan zwyczajny, kukurydza zwyczajna, orzech ziemny, łzawnica ogrodowa (Coix lacryma – jobi), Centrosema pubescens, Euphorbia heterophylla, Ficus exasperata, wilec ziemniaczany, Eynodon nlemfuensis, cukrowowiec lekarski, olejowiec gwinejski, pochrzyn, mango indyjskie, ananas jadalny, kaczany, otręby, chleb, odpady kuchenne[22].
Mięso T. swinderianus należy do jednych z najbardziej poszukiwanych i najdroższych w zachodniej Afryce[26][37]. Jest dla miejscowej ludności cennym źródłem białka[38][16].
Pasożyty[edytuj | edytuj kod]
Na T. swinderianus pasożytują: nicienie Paralibyostrongylus hebrenicutus[39], Paralibyostrongylus vondevei, Longistriata spira, Trachypharynx natalensis oraz przedstawiciele rodzajów: Ascaris i Trichuris, przywra krwi[22], tasiemce z rodzaju Taenia[39] oraz Furhmanella transvaalensis, Raillietina mahone[22], a także kleszcze z rodzajów: Dermocentor, Rhipicephalus (m.in. Rhipicephalus simpsoni), Haemaphysalis (Haemaphysalis permata), Ixodes (m.in. Ixodes aulacodi)[22].
Siedlisko[edytuj | edytuj kod]
Gryzonie te żyją na podmokłych, trawiastych terenach. Lubią lasy sawanny[17], bagna i brzegi rzek[40]. Czasami zamieszkują pola uprawne i zjadają plony. Szczecińce większe nie budują nor[25], ale chętnie zamieszkują w gotowych, wykopanych przez inne gatunki ziemnych schronieniach[17]. Niektórzy badacze twierdzą jednak, że T.swinderianus także kopie własne schronienia, a zajmowanie cudzych nor jest okazjonalne[2].
Hodowla[edytuj | edytuj kod]

W Afryce powstaje coraz więcej farm hodujących szczecińce większe[26]. Intensywna produkcja jest prowadzona między innymi w Beninie, Togo, Kamerunie, Wybrzeżu Kości Słoniowej, Gabonie, Ghanie, Nigerii, Senegalu i Demokratycznej Republice Konga. Powodem są walory smakowe mięsa, niskie koszty i łatwość założenia hodowli[41] oraz duża jej opłacalność. Hodowle są prowadzone na terenach wiejskich i podmiejskich. Ze względu na fakt, że Thryonomys swinderianus nie ma instynktu kopania w ziemi, hodowla jest możliwa nie tylko w klatkach, ale także na otwartej przestrzeni ogrodzonej murem z gliny[17]. W takich hodowlach możliwe jest utrzymywanie samców i samic we wspólnej przestrzeni.
Hodowla szczecińców większych spotyka się z zachętą rządów poszczególnych państw afrykańskich, które upatrują w niej jeden ze sposobów zapewnienia wyżywienia lokalnej ludności[18][17]. Według danych z 2010 roku rocznie na rynek lokalny Afryki Subsaharyjskiej trafia ponad 73 tony mięsa tych zwierząt, pochodzącego z uboju ponad 15 000 sztuk[2]. Mięso szczecińców większych może zdominować lokalny handel mięsny. Jest ono delikatne, zawiera dużo białka i mniej tłuszczu[42] niż wołowina, baranina, a nawet koźlęcina.
T. swinderianus jest także hodowany w laboratoriach dla celów badawczych[37].
Zagrożenia i ochrona[edytuj | edytuj kod]
Populacja szczecińców większych jest dość intensywnie przetrzebiana[37][43] – głównie ze względu na poszukiwane mięso, ale także jako szkodniki niszczące uprawy, w tym szczególnie trzciny cukrowej[32]. Dużym zagrożeniem dla gatunku są także wielkie pożary buszu[37].
Przypisy[edytuj | edytuj kod]
- ↑ Thryonomys swinderianus, [w:] Integrated Taxonomic Information System (ang.).
- ↑ a b c d e f g h i j k l m n o p q r Maxwell N. Opara. Grasscutter: The haematology and major parasites. „Research Journal of Parasitology”. 5 (4), s. 214–223, 2010. Academic Journals Inc.. (ang.).
- ↑ C.J. Temminck: Monographies de Mammalogie, ou description de quelques genres de mammifères, dont les espèces ont été observées dans lens différens musées de l’Europe. Cz. 1. Amsterdam: Chez G. Dufour, 1827, s. 248. (fr.).
- ↑ W.C.H. Peters: Naturwissenschaftliche Reise nach Mossambique, auf Befehl Seiner Majestät des Königs Friedrich Wilhelm IV, in den Jahren 1842 bis 1848 ausgeführt. Zoologie. I Säugethiere. Berlin: G. Reimer, 1852, s. 138. (niem.).
- ↑ T. von Heuglin. Bericht über einige grössere Nagethiere Central-Afrika’s.. „Novorum actorum Academiae Caesareae Leopoldino-Carolinae Germanicae Naturae Curiosorum”. 31 (7), s. 6, 1964. (niem.).
- ↑ E. de Pousargues. Note sur une nouvelle espèce d’Aulacode, Aulacodus calamophagus (De Beerst), provenant de la région des Lacs. „Bulletin du Muséum d’histoire naturelle”. 3, s. 160, 1897. (fr.).
- ↑ a b O. Thomas. On the animals known as “ground-hogs” or “cane-rats” in Africa. „The Annals and Magazine of Natural History”. Ninth series. 9 (52), s. 392, 1922. (ang.).
- ↑ A.S. Romer & P.H. Nesbitt. An extinct cane-rat (Thryonomys logani, sp. n.) from the central Sahara. „The Annals and Magazine of Natural History”. Teenth series. 6 (36), s. 688, 1930. DOI: 10.1080/00222933008673274. (ang.).
- ↑ a b D.M.A. Bate. An extinct reed-rat (Thryonomys arkelli) from the Sudan. „The Annals and Magazine of Natural History”. Eleventh series. 14 (109), s. 65, 1947. DOI: 10.1080/00222934708654610. (ang.).
- ↑ a b Thryonomys swinderianus, [w:] The IUCN Red List of Threatened Species (ang.).
- ↑ a b c d Włodzimierz Cichocki, Agnieszka Ważna, Jan Cichocki, Ewa Rajska, Artur Jasiński, Wiesław Bogdanowicz: Polskie nazewnictwo ssaków świata. Warszawa: Muzeum i Instytut Zoologii Polskiej Akademii Nauk, 2015, s. 297. ISBN 978-83-88147-15-9.
- ↑ Zygmunt Kraczkiewicz: SSAKI. Wrocław: Polskie Towarzystwo Zoologiczne – Komisja Nazewnictwa Zwierząt Kręgowych, 1968, s. 81, seria: Polskie nazewnictwo zoologiczne.
- ↑ Wilson Don E. & Reeder DeeAnn M. (red.) Thryonomys swinderianus. w: Mammal Species of the World. A Taxonomic and Geographic Reference (Wyd. 3.) [on-line]. Johns Hopkins University Press, 2005. (ang.) [dostęp 2 stycznia 2011]
- ↑ a b c d Continued harvest of the diverse African Animal Genetic Resources from the wild through domestication as a strategy for sustainable use: A case of the larger Grass cutter (Thryonomys swinderianus). Animal Genetic Resources (AnGR). [dostęp 2011-01-11]. (ang.).
- ↑ a b c Ministry Of Food And Agriculture Information Resource Centre, Accra-Ghana: GRASSCUTTER PRODUCTION GUIDE. 20 sierpnia 2008. [dostęp 2011-01-08]. (ang.).
- ↑ a b A.P. Den Hartog, A. De Vos. The use of rodents as food in tropical Africa. „FAO Nutrition Newsletter”. 111, s. 1–4, 1973. FAO. (ang.).
- ↑ a b c d e f g Yaa Ntiamoa-Baidu. Wildlife and food security in Africa. „FAO CONSERVATION GUIDE”. 33, 1997. FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS. (ang.).
- ↑ a b Promoting Grasscutter as a Business in West Africa. Proceedings of the International Forum on Grasscutter Theme; Ghana, grudzień 2005. [dostęp 2011-01-06]. (ang.).
- ↑ Suzette K. Mouchaty, Francois Catzeflis, Axel Janke, Ulfur Arnason. Molecular Evidence of an African Phiomorpha–South American Caviomorpha Clade and Support for Hystricognathi Based on the Complete Mitochondrial Genome of the Cane Rat (Thryonomys swinderianus). „Molecular Phylogenetics and Evolution”. 18 (1), s. 127–135, 2001. [dostęp 2011-01-06]. (ang.).
- ↑ Alfred Brehm: Brehms Thierleben. Allgemeine Kunde des Thierreichs. Leipzig: Verlag des Bibliographischen Instituts, 1883.
- ↑ a b c d e f g h i Mac van der Merwe, PhD: Cane Rats (Thryonomyidae). novelguide.com. [dostęp 2011-02-21]. (ang.).
- ↑ a b c d e f g h i j Maxwell N. Opara. The Grasscutter I: A Livestock of Tomorrow. „Research Journal of Forestry”. 4 (3), s. 119–135, 2010. Academic Journals Inc.. (ang.).
- ↑ Ferran Jori, G.A. Mensah, E. Adjanohoun. Grasscutter production: an example of rational exploitation of wildlife. „Biodiversity and Conservation”. 4 (3), s. 257–265, 1995. Hawksworth. (ang.).
- ↑ a b c d e f R.F. Ewer. Form and function in the grasscutter Thrynomys Swinderianus Temminck 1827 (Rodentia, Thrynomyidae). „Ghana Journal of Science”. 9, s. 131–149, 1969. (ang.).
- ↑ a b c S.S. Aja Yi, O.O. Tewe. Food preference and carcass composition of the grass cutter(Thryonomys swinderianus)in captivity. „African Journal of Ecology”. 18, s. 133–140, 1980. Frederick Kayanja, Bryan Shorrocks and Julius Lejju. (ang.).
- ↑ a b c O. Byanet, B.I. Onyeanusi, N. D. G Ibrahim. Sexual Dimorphism with Respect to the Macro-Morphometric Investigations of the Forebrain and Cerebellum of the Grasscutter (Thryonomys swinderianus). „International Journal of Morphology”. 27(2), s. 361–365, 2009. [dostęp 2011-01-06]. (ang.).
- ↑ M. Merve. Tooth succession in the greater cane rat (Thrynomys swinderianus) (Temminck,1827). „Journal of Zoology”. 251, s. 535–547, 2000. American Society of Mammologists. (ang.).
- ↑ a b E.K. Adu: Grasscutter Farming: A manual for Beginners. INTSI/CSIR Ghana, 1999.
- ↑ Phyllis Gertrude Addo. Domesticating the wild grasscutter (Thrynomys swinderianus Temminck, 1827) under laboratory conditions. „Praca doktorska”, 1997. (ang.).
- ↑ a b c d Phyllis G. Addo, S. Adjei, B. Awumbila, E. Awotwi i inni. Determination of the ovulatory mechanism of the grasscutter Thrynomys swinderianus. „Animal Reproduction Science”. 71, s. 125–137, 2002. Elsevier B.V.. PMID: 11988376. (ang.).
- ↑ Ferran Jori, P. Chardonnet. Cane rat farming in Gabon status and perspective.. „Proceedings of the 5th International Wildlife Ranching Symposium”, s. 33–51, 2001. U.A.B.. (ang.).
- ↑ a b Greater Cane Rat. Kruger National Park: South Africa Safari. [dostęp 2011-02-22]. (ang.).
- ↑ a b J.M. Cox, S.L. Marinier, A.J. Alexander. Auditory communication in the cane rat (Thryonomys swinderianus). „Journal of Zoology”. 216 (1), s. 141–167, 1988. Zoological Society of London. (ang.).
- ↑ Cane rat. Wildsafari.info. [dostęp 2011-02-21]. (ang.).
- ↑ a b Alfred Sherwood Romer, Paul H. Nesbitt. An extinct cane-rat (Thryonomys logani sp.n.) from the central Sahara. „Annals and Magazine of Natural History”. 6, s. 687–690, 1930. J i J.E.Tylor. (ang.).
- ↑ F. Fitzinger. Cane rats. „Walker’s Mammals of the World”, s. 1650–1651, 1995. Johns Hopkins University Press. (ang.).
- ↑ a b c d Emmanuel O.A. Asibey, Phyllis Gertrude Addo: The grasscutter, a promising animal meat production in Ghana; w: David Turnham: „African Perspectives: Practices and Policies Supporting Sustainable Development”. Scandinavian Seminar College, 2000. ISBN 0-7974-2031-2.
- ↑ E.O.A. Asibey. Wildlife as a source of protein in Africa South of the Sahara. „Biological conversation”. 6, s. 32–39, 1974. (ang.).
- ↑ a b Ferran Jori, J.E. Cooper, J. Casal. On post mortem findings in captive cane rats (Thrynomys swinderianus) in Gabon. „Vetrinary Record”. 148, s. 624–628, 2001. British Veterinary Association. (ang.).
- ↑ Thryonomys swinderianus. Animal Diversity Web. [dostęp 2011-01-02]. (ang.).
- ↑ BBC News 3 kwietnia 2006.
- ↑ Emmanuel O.A. Asibey. Wildlife Wildlife as a source of protein in Africa South of the Sahara. „Biological Conservation”. 6, s. 32–39, 1974. Elsevier BV. (ang.).
- ↑ S. Yeboah, E.K. Adamu. The Cane Rat. „Biologist”. 42(2), s. 86–87, 1995. (ang.).


