Zespół ucisku pnia trzewnego
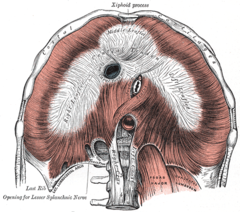 Więzadło łukowate pośrodkowe (mogące uciskać pień trzewny odchodzący od aorty) to włóknisty łuk uformowany przez lewą (na ryc. Left Crus) i prawą odnogę (na ryc. Right Crus) przepony. | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|
Zespół ucisku pnia trzewnego także zespół Dunbara, zespół Harjoli-Marabla (ang. median arcuate ligament syndrome, MALS; Harjola-Marable syndrome; Marable syndrome) – zespół objawów przypisywany uciskowi pnia trzewnego i ewentualnie zwoju trzewnego przez więzadło łukowate pośrodkowe[1]. Ból brzucha może być powiązany z posiłkami, przy jednoczesnej utracie masy ciała. Wystąpić mogą także szmery brzuszne, możliwe do wychwycenia przez klinicystę. Określany jest również jako zespół więzadła łukowatego pośrodkowego[2].
Podstawą rozpoznania zespołu jest wykluczenie innych możliwych przyczyn dolegliwości, jako że wielu zdrowych pacjentów wykazuje pewien stopień ucisku pnia trzewnego, przy braku objawów. W rezultacie, rozpoznanie MALS może zostać przedstawione po wykluczeniu bardziej pospolitych schorzeń. Po pojawieniu się podejrzeń istnieje możliwość wykonania testu przesiewowego w kierunku zespołu przy pomocy badania ultrasonograficznego i ostatecznie potwierdzone z pomocą tomografii komputerowej lub rezonansu magnetycznego z podaniem kontrastu (angiografia).
Stosowane jest leczenie chirurgiczne bazujące na cięciu pośrodkowym lub pod łukami żebrowymi. Podcięte zostaje więzadło łukowate pośrodkowe, pień trzewny uwolniony, a splot trzewny odbarczony[3]. Większość pacjentów odczuwa poprawę po zabiegu. Słabsze reakcje na leczenie obserwowane były u młodszych pacjentów, pacjentów z zaburzeniami psychicznymi lub nadużywających alkoholu, posiadających bóle brzucha nieskorelowane z posiłkami lub nie zauważono u nich utraty masy ciała.
Anatomia i patogeneza[edytuj | edytuj kod]
Więzadło łukowate pośrodkowe jest częścią przepony, znajduje się w miejscu gdzie łączą się jej prawa i lewa odnoga, w okolicach 12. kręgu piersiowego. Ten włóknisty łuk tworzy przedni obszar rozworu aortalnego, poprzez który przechodzi aorta, przewód piersiowy oraz żyła nieparzysta. Więzadło łukowate pośrodkowe zazwyczaj styka się z aortą powyżej odnogi pnia trzewnego. Jednakże, u blisko jednej czwartej osobników więzadło przechodzi przed pniem trzewnym, powodując ucisk pnia oraz okolicznych struktur, takich jak zwój trzewny[1]. U niektórych osobników ucisk jest patologiczny i prowadzi do zespołu ucisku tętnicy krezkowej[1].
Kilka teorii próbuje wyjaśnić źródło bólu powstającego w wyniku ucisku pnia trzewnego[4]. Niektórzy uważają, że ucisk pnia trzewnego powoduje niedokrwienie lub obniża przepływ krwi do narządów brzusznych, prowadząc do powstania bólu. Inni sugerują, że ucisk może być również wywierany na zwój trzewny, a ból jest efektem owego ucisku.
Epidemiologia[edytuj | edytuj kod]
Szacuje się, że u 10–24% zdrowych osób bez objawów, więzadło łukowate pośrodkowe krzyżuje się przed pniem trzewnym, powodując pewien stopień ucisku[1][5]. Około jeden procent tych osób cierpi na ucisk powodujący objawy charakterystyczne dla MALS[1]. Zespół najczęściej dotyka osoby pomiędzy 20. a 40. rokiem życia i jest bardziej powszechny wśród kobiet, w szczególności szczupłych[1].
Objawy i przebieg[edytuj | edytuj kod]
Pacjenci z MALS skarżą się na ból brzucha, zlokalizowany najczęściej w nadbrzuszu, co może mieć związek z przyjmowaniem pokarmów i prowadzić do jadłowstrętu i utraty wagi[1]. W niektórych przypadkach badanie przedmiotowe może wykazać szmery brzuszne w środkowym nadbrzuszu[1].
Powikłania MALS pochodzą od przewlekłego ucisku pnia trzewnego. Wśród nich wymienia się gastroparezę[6] oraz tętniaka tętnicy żołądkowo-dwunastniczej[7].
Rozpoznanie[edytuj | edytuj kod]
Rozpoznanie zespołu ucisku tętnicy krezkowej następuje przez wykluczenie innych przyczyn[1][4]. Oznacza to, że rozpoznanie MALS brane jest pod uwagę dopiero po przejściu badań układu pokarmowego włączając w to esofagogastroduodendoskopię, kolonoskopię i badania w kierunku choroby refluksowej przełyku i chorób pęcherzyka żółciowego[4].
Rozpoznanie MALS opiera się na połączeniu ze sobą cech klinicznych i obrazowania medycznego[1]. Cechy kliniczne obejmują oznaki i symptomy wymienione powyżej; w klasycznym przypadku, na MALS przypada triada objawów: ból po jedzeniu, utrata wagi oraz szmery brzuszne, pomimo że kompletna triada występuje u mniejszości osób ze zdiagnozowanym MALS[4].
Badania obrazowe wykonywane w diagnostyce MALS dzielone są na przesiewowe i potwierdzające[4]. Za podstawowe badanie przesiewowe dla pacjentów z podejrzeniem MALS uważa się USG dopplerowskie, z pomiarem przepływu krwi przez pień trzewny[4][8]. Szczytowe prędkości skurczowe większe niż 200 cm/s sugerują zwężenie pnia trzewnego, powiązanego z MALS[4].
|
Dalsza ocena i potwierdzenie zespołu może być uzyskane z pomocą angiografii, w celu zbadania anatomii pnia trzewnego[4]. W przeszłości wykorzystywana była konwencjonalna angiografia, która w dużej mierze została wyparta przez mniej inwazyjne metody, takie jak tomografia komputerowa i rezonans magnetyczny[1][4]. Ze względu na lepsze możliwości uwidocznienia struktur brzusznych częściej wykorzystywana jest tomografia komputerowa[4]. Wyniki uzyskane za pomocą Angio-CT (tomografia komputerowa angiograficzna) wspomagają zdiagnozowanie MALS[1]. Podczas wydechu, u pacjentów z MALS, a nawet zdrowych ludzi, badania obrazowe mogą sugerować większe zwężenie niż w rzeczywistości.
Ogniskowe zwężenie proksymalnego odcinka pnia trzewnego z rozszerzeniem poststenotycznym może być zaobserwowane w innych schorzeniach, mających wpływ na pień trzewny[1]. Hakowaty kształt konturu pnia trzewnego jest charakterystyczny dla anatomii MALS i pozwala na odróżnienie go od innych przypadków zwężenia pnia trzewnego, takich jak miażdżyca[1]. Zakrzywiony hakowaty kształt nie jest jednak specyficzny wyłącznie dla MALS, jako że 10–24% osób bez widocznych objawów posiada taką anatomię[1].
Leczenie[edytuj | edytuj kod]
Podstawowym zabiegiem w leczeniu MALS jest odbarczenie pnia trzewnego[4]. Stosuje się cięcie pośrodkowe lub pod łukami żebrowymi. Podcięte zostaje więzadło łukowate pośrodkowe, a pień trzewny uwolniony[4]. Po zabiegu ocenia się przepływ krwi przez pień trzewny np. za pomocą czynnościowego badania ultrasonograficznego. Jeśli, pomimo operacji, przepływ krwi jest zbyt mały często przeprowadza się również rewaskularyzację, np. przez pomostowanie aortalno-wieńcowe lub angioplastykę[4].
Podejście laparoskopowe również może być wykorzystane do zmniejszenia ucisku na pień trzewny[9]; jeśli w trakcie zabiegu okaże się, że niezbędna jest rewaskularyzacja, konieczna będzie laparotomia[4].
Wewnątrznaczyniowe metody, takie jak przezskórna transluminalna angioplastyka (PTA), stosowane były u osób, u których zawiodły metody laparoskopowe i laparotomijne[4]. Zastosowanie wyłącznie PTA, bez usunięcia ucisku pnia trzewnego, może nie przynieść żadnych korzyści[10][4].
Prognoza[edytuj | edytuj kod]
Istnieje kilka badań dotyczących długoterminowych efektów leczenia pacjentów z MALS[4]. Według Duncana[4], największe i najbardziej znaczące wyniki pochodzą ze studiów 51 pacjentów po przejściu chirurgicznego leczenia MALS, spośród których 44 było dostępnych w ramach terapii średnio przez 9 lat po zabiegu[11]. Badania pokazały, że u 75% pacjentów, którzy przeszli odbarczenie splotu trzewnego oraz rewaskularyzację, nastąpił zanik objawów. Największą poprawę zanotowano u osób:
- w wieku od 40 do 60 lat,
- nie pijących alkoholu oraz nie cierpiących na zaburzenia psychiczne,
- cierpiących na ból brzucha występujący po posiłku,
- u których spadek masy ciała był większy niż 20 funtów (9,1 kg).
Historia[edytuj | edytuj kod]
Ucisk pnia trzewnego został po raz pierwszy zaobserwowany przez Benjamina Lipschütza w 1917 roku[12]. MALS został po raz pierwszy opisany przez Pekkę-Tapaniego Harjolę w 1963 roku[13], a następnie przez J. Davida Dunbara oraz Samuela Marabla w 1965 roku[14]. Z tego powodu nazywany jest również zespołem Harjoli-Marabla oraz zespołem Marabla[12].
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e f g h i j k l m n o p Horton KM, Talamini MA, Fishman EK. Median arcuate ligament syndrome: evaluation with CT angiography. „Radiographics”. 25 (5), s. 1177–82, 2005. DOI: 10.1148/rg.255055001. PMID: 16160104.
- ↑ Mirosław Osiecki, Paweł Żukowski, Krzysztof Brzozowski, Bernard Jaroń, Marcin Feliga, Paweł Twarkowski. Ocena arteriograficzna czynnościowego zwężenia pnia trzewnego - doświadczenia własne. „Chirurgia Polska”. 5 (4), s. 229-34, 2003.
- ↑ Paweł Stelmasiak, Jan Nyckowski: Zespół uciskowy pnia trzewnego (syndrom Dunbara). [dostęp 2011-01-04]. (pol.).
- ↑ a b c d e f g h i j k l m n o p q r Duncan AA. Median arcuate ligament syndrome. „Curr Treat Options Cardiovasc Med”. 10 (2), s. 112–6, 2008. DOI: 10.1007/s11936-008-0012-2. PMID: 18325313.
- ↑ Lindner HH, Kemprud E. A clinicoanatomical study of the arcuate ligament of the diaphragm. „Arch Surg”. 103 (5), s. 600–5, 1971. PMID: 5117015.
- ↑ Balaban DH, Chen J, Lin Z, Tribble CG, McCallum RW. Median arcuate ligament syndrome: a possible cause of idiopathic gastroparesis. „Am. J. Gastroenterol”. 92 (3), s. 519–23, 1997. PMID: 9068484.
- ↑ Manghat NE, Mitchell G, Hay CS, Wells IP. The median arcuate ligament syndrome revisited by CT angiography and the use of ECG gating--a single centre case series and literature review. „Br J Radiol”. 81 (969), s. 735–42, 2008. DOI: 10.1259/bjr/43571095. PMID: 18541631.
- ↑ Sproat IA, Pozniak MA, Kennell TW. US case of the day. Median arcuate ligament syndrome (celiac artery compression syndrome). „Radiographics”. 13 (6), s. 1400–2, 1993. PMID: 8290734.
- ↑ Carbonell AM, Kercher KW, Heniford BT, Matthews BD. Multimedia article. Laparoscopic management of median arcuate ligament syndrome. „Surg Endosc”. 19 (5), s. 729, 2005. DOI: 10.1007/s00464-004-6010-x. PMID: 15965588.
- ↑ Matsumoto AH, Tegtmeyer CJ, Fitzcharles EK, et al. Percutaneous transluminal angioplasty of visceral arterial stenoses: results and long-term clinical follow-up. „J Vasc Interv Radiol”. 6 (2), s. 165–74, 1995. DOI: 10.1016/S1051-0443(95)71087-9. PMID: 7787348.
- ↑ Reilly LM, Ammar AD, Stoney RJ, Ehrenfeld WK. Late results following operative repair for celiac artery compression syndrome. „J. Vasc. Surg.”. 2 (1), s. 79–91, 1985. DOI: 10.1067/mva.1985.avs0020079. PMID: 3965762.
- ↑ a b synd/4106 w bazie Who Named It (ang.)
- ↑ Harjola PT. A rare obstruction of the coeliac artery. Report of a case. „Ann Chir Gynaecol Fenn”. 52, s. 547–50, 1963. PMID: 14083857.
- ↑ Dunbar JD, Molnar W, Beman FF, Marable SA. Compression of the celiac trunk and abdominal angina. „Am J Roentgenol Radium Ther Nucl Med”. 95 (3), s. 731–44, 1965. PMID: 5844938.


