Brassinosteroidy
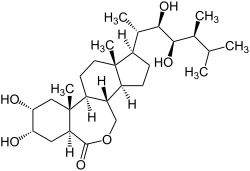
Brassinosteroidy, brasinosteroidy, BR – grupa sterydowych hormonów roślinnych. Pierwszym odkrytym brassinosteroidem był brasinolid, który w roku 1979 w roku został wyizolowany z pyłku rzepaku Brassica napus[1]. Związek ten odpowiada głównie za wydłużenie łodygi, stymulacje podziały komórkowe oraz ochronę roślin przed stresem środowiskowym[2]. Wydajność pozyskiwania brassinsteroidów jest bardzo niska, z 230 kg Brassica napus można uzyskać jedynie 10 mg brasinolidu. Od momentu odkrycia zostało wyizolowanych z różnych roślin ponad 70 brassinosteroidów[3]. Pod względem chemicznym są podobne do hormonów zwierzęcych. Przemiany metaboliczne, zarówno dokładny szlak biosyntezy i katabolizm BRs, są nadal zagadką dla człowieka. Wiąże się z nimi nadzieje w wykorzystaniu w rolnictwie i jako potencjalne związki farmakologicznie czynne.
Biosynteza[edytuj | edytuj kod]
Brassinosteroidy są wytwarzane z kampesterolu. Wyróżniany jest szlak biosyntezy BRs mewalonianowy u roślin wyższych i niemewalonianowy u roślin niższych. Następnie rozgałęzia się na ścieżkę cykloartenol- i cykloartanol-zależną. C27-BRs są przekształcane do C28-norBL, gdzie synteza C29 pochodnej jest inicjowana przez β-sitosterol i prowadzi do wytworzenia C28-homoBL. Na przykładzie powstawania jak dotąd najbardziej poznanego brassinosteroidu, czyli brassinolidu, wyróżniono trzy ścieżki prowadzące do powstania C27-, C28- i C29-pochodnych[1]. Z kampesterolu w szeregu reakcji przekształcają się kolejno w kampastenol, katasterol, teasterol, tyfasterol, kastasteron (CS) i wreszcie brassinolid (BL). Przemiana kastasteronu do brassinolidu nie zachodzi jedynie u tytoniu szlachetnego Nicotiana tabacum i ryżu siewnego Orryza sativa[4]. Każdy kolejny metabolit w szlaku biosyntezy ma aktywność większą niż jego poprzednik i tak CS ma właściwości słabsze od BL[4]. Po raz pierwszy szlak syntezy został opisany przez badaczy japońskich, a następnie skorygowany przez analizę mutantów pod względem biosyntezy brassinosteroidów u rozdkiewnika pospolitego, pomidorów i grochu[5]. Miejsce syntezy brassinosteroidów nie zostało doświadczalnie ustalone. Przyjmuje się hipotezę, że wszystkie tkanki roślinne są zdolne do syntezy BR, ale jedynie w niektórych z organów roślinnych dochodzi do ekspresji genów odpowiedzialnych za tworzenie łańcucha przekazywania sygnału. Hipotezę to potwierdzają obserwacje stosunkowo niewielkiego zasięgu działania hormonów z grupy brassinosteroidów[6][7]. Doświadczenia wykazały, że akropetalny transport brassinosteroidów na większe odległości w organizmach roślin jest możliwy, jednak nie wiadomo, czy taki transport ma jakieś znaczenie biologiczne[6].

Budowa chemiczna[edytuj | edytuj kod]
Brassinosteroidy swoją budową chemiczną są podobne do hormonów zwierzęcych. Mają budowę 5α-cholesteranu i wykazują podobieństwo do cholesterolu czy hormonów płciowych[8]. Do czterech cyklicznych pierścieni przyłączony jest łańcuch boczny przy węglu C17. W budowie BRs wyróżniono pierścienie A, B, C i D. Pierścień B ma właściwości heterocykliczne, gdzie możliwa jest modyfikacja polegająca na utracie właściwości heterocyklicznych i podstawienia grupą ketonową. Do pierścienia A mogą zostać przyłączone grupy hydroksylowe lub epoksydowe. Także do łańcucha bocznego mogą być przyłączone grupy hydroksylowe[9]. BRs mogą ulegać szeregom reakcji, głównie katabolicznych np. glukozylacji czy estryfikacji, które to prowadzą do ich inaktywacji.
Rola[edytuj | edytuj kod]
BRs są znajdowane w większych ilościach w młodych tkankach roślinnych. Cząsteczka brassinosteroidu przyłącza się do receptora błonowego BRI1 i powstaje kompleks hormon-receptor, który ma właściwości kinazy BAK1[8]. Wnika do jądra komórkowego, gdzie odnajduje właściwe miejsce w chromatynie. Zachodzą procesy transkrypcji i translacji, po czym wydzielane jest nowe białko. Wykazany został udział brassinosteroidów w licznych procesach zachodzących w roślinach, głównie anabolicznych:
- Stymulacja wzrostu i wydłużania komórek[6] we współdziałaniu z auksynami[10].
- Niejasną rolę odgrywają także w podziałach komórkowych i odtwarzaniu ściany komórkowej[6].
- Wywołują różnicowanie się komórek naczyniowych[11].
- Są konieczne przy formowaniu łagiewki pyłkowej[12].
- Przyspieszają starzenie się komórek w zamierających hodowlach tkankowych, gdzie współdziałają z etylenem, powodując szybsze dojrzewanie owoców. Opóźnienie starzenia w mutantach o obniżonej ilości brassinosteroidów wskazuje na takie działanie także w całych roślinach[6].
- Mogą działać ochronnie podczas okresu chłodu i suszy działającej na rośliny[6].
Właściwości[edytuj | edytuj kod]
Właściwości antynowotworowe i przeciwproliferacyjne[edytuj | edytuj kod]
Brassinosteroidy wykazują działanie przeciwnowotworowe, przerywając cykl komórkowy w fazie S i zmniejszając proporcje komórek w fazie G0/G1 do komórek w fazie S, kierują je na drogę apoptozy[13]. Wykazano to na liniach komórkowych raka gruczołu krokowego LNCaP i raka sutka MCF-7[13]. BRs nie działają negatywnie na zdrowe komórki, zaś najwyższą aktywność stwierdzono dla kastasteronu, 28-homokastasteronu i 24-epibrassinolidu[14]. BRs mają także właściwości hamujące angiogenezę i wzrost guza. Przebadano komórki śródbłonka linii HMEC-1, działając na nie 24-epibrassinolidem. Wyniki udowodniły zmniejszenie zdolności komórek nowotworowych do migracji i ich właściwości proliferacyjnych[13]. Wykazano to na liniach komórkowych raka gruczoły krokowego LNCaP i raka sutka MCF-7[13].

Właściwości przeciwdrobnoustrojowe[edytuj | edytuj kod]
Brassinosteroidy mają właściwości antywirusowe, antybakteryjne i przeciwgrzybicze. BRs, te naturalne i syntetyczne, działają na szereg wirusów, w tym wirusa polio i arenowirusy. Wykazano również działanie na oba typy wirusa opryszczki (HSV)[15]. Hamują syntezę wirusowych kwasów nukleinowych i antygenów oraz zmniejszają powinowactwo wirusowych receptorów do receptorów komórkowych. Zwiększają wydzielanie interleukin i TNFα pomagając zwalczać infekcje wirusowe. Udowodniono wpływ BRs na zakażenie wirusem HIV przez hamowanie wirusowych proteaz[16].
Działanie przeciwzapalne i neuroprotekcyjne[edytuj | edytuj kod]
Działanie przeciwzapalne wykazano dla syntetycznych BRs, które hamowały objawy zapalenia w trzy dni[17]. Większość zsyntetyzowanych BRs ma budowę podobną do deksametazonu, co odpowiada za ich przeciwzapalne działanie. Ich działanie polega na hamowaniu wytwarzania cytokin prozapalnych i prostaglandyn, a zwiększeniu wydzielania interferonu i działających protekcyjnie: witaminy A i witaminy E. Redukują działanie stresu oksydacyjnego wywołanego przez wolne rodniki. Udowodniono nasiloną produkcję leukocytów, co mobilizowało odpowiedź obronną organizmu na zapalenie. BRs zwiększały migrację fibroblastów i kolagenu do miejsca zranienia, a hamowały wyrzut TNFα, a co za tym idzie – promowały gojenie się ran[18]. Ich możliwość zwiększenia produkcji kolagenu daje nadzieję na zastosowanie w terapii przeciwzmarszczkowej. Działanie neuroprotekcyjne BRs związane jest z ich możliwością łagodzenia stresu oksydacyjnego oraz zmniejszenia działania wolnych rodników przez enzymy takie jak np. dysmutaza ponadtlenkowa czy katalaza. Czynniki odpowiedzialne za stres oksydacyjny promują starzenie się komórki i jej obumieranie przez nagromadzenie się w niej mutacji. Kastasteron (CS) przeciwdziałał nagromadzeniu się mutacji wywołanych przez H2O2 w ludzkich limfocytach o 89%[13]. Wykazano to na liniach komórkowych raka prostaty LNCaP i raka piersi MCF-7[13]. Niektóre choroby neurodegeneracyjne, jak choroba Parkinsona czy choroba Alzheimera, wywołane są przez działanie stresu oksydacyjnego. Spożywanie roślin zawierających prekursor dopaminy, czyli L-DOPĘ, i BRs działało protekcyjne na neurony dopaminergiczne i hamowało ich obumieranie[13]. Wykazano to na liniach komórkowych raka gruczołu krokowego LNCaP i raka sutka MCF-7[13].
Działanie przeciwcholesterolowe[edytuj | edytuj kod]
Spożywanie steroli roślinnych zmniejsza stężenie cholesterolu LDL i VLDL dzięki kompetycyjnemu wchłanianiu tłuszczów w jelitach i niewchłanianiu samych siebie. Spożywanie steroli roślinnych, w tym BRs, zmniejszało stężenie LDL i VLDL, nie zmieniając poziomu HDL[19]. Sterole roślinne zmniejszają także agregację płytek krwi, chroniąc przed zakrzepami. Przeciwdziałają powstawaniu miażdżycy. BRs są nadzieją w terapii przeciwcholesterolowej u pacjentów leczonych statynami dotkniętych rabdomiolizą[20].
Przypisy[edytuj | edytuj kod]
- ↑ a b Andrzej Bajguz, Magdalena Chmur, Damian Gruszka. Comprehensive Overview of the Brassinosteroid Biosynthesis Pathways: Substrates, Products, Inhibitors, and Connections. „Frontiers in Plant Science”. DOI: 10.3389/fpls.2020.01034. (ang.).
- ↑ J.W. Mitchell i inni, Brassins – a new family of plant hormones from rape pollen, „Nature”, 225, 1970, s. 1065–1066, DOI: 10.1038/2251065a0, PMID: 16056912 (ang.).
- ↑ Andrzej Bajguz, Metabolism of brassinosteroids in plants, „Plant Physiology and Biochemistry”, 45 (2), 2007, s. 95–107, DOI: 10.1016/j.plaphy.2007.01.002, PMID: 17346983 (ang.).
- ↑ a b Andrzej Bajguz, Romuald Czerpak. Biosynteza i przemiany metaboliczne brassinosteroidów. „KOSMOS Problemy Nauk Biologicznych”, s. 259-268, 1997. Polskie Towarzystwo Przyrodników im. Kopernika. (pol.).
- ↑ Shozo Fujioka, Akira Sakurai, Biosynthesis and metabolism of brassinosteroids, „Physiologia Plantarum”, 100 (3), 1997, s. 710–715, DOI: 10.1111/j.1399-3054.1997.tb03078.x, PMID: 14502988 (ang.).
- ↑ a b c d e f S.D. Clouse, J.M. Sasse, Brassinosteroids: Essential regulators of plant growth and development, „Annual Review of Plant Physiology and Plant Molecular Biology”, 49, 1998, s. 427–451, DOI: 10.1146/annurev.arplant.49.1.427, PMID: 15012241 (ang.).
- ↑ Jianming Li, Joanne Chory, A putative leucine rich repeat receptor kinase involved in brassinosteroid signal transduction, „Cell”, 90, 1997, s. 929–938, DOI: 10.1016/S0092-8674(00)80357-8, PMID: 9298904 (ang.).
- ↑ a b Jiao Tang, Zhifu Han, Chai, J.. Q&A: what are brassinosteroids and how do they act in plants?. „BMC Biology”. 14, 113, 2016. DOI: 10.1186/s12915-016-0340-8.
- ↑ Jianming Li. Brassinosteroids. „Encyclopedia of Hormones”, 2003. (ang.).
- ↑ Jennifer L. Nemhauser, Todd C. Mockler, Joanne Chory, Interdependency of Brassinosteroid and Auxin Signaling in Arabidopsis, „PLoS Biology”, 2 (9), 2004, E258, DOI: 10.1371/journal.pbio.0020258, PMID: 15328536, PMCID: PMC509407 (ang.).
- ↑ Ana Caño-Delgado i inni, BRL1 and BRL3 are novel brassinosteroid receptors that function in vascular differentiation in Arabidopsis, „Development”, 131, 2004, s. 5341–5351, DOI: 10.1242/dev.01403, PMID: 15486337 (ang.).
- ↑ F.R. Hewitt i inni, Effect of brassinolide and other growth regulators on the germination and growth of pollen tubes of Prunus avium using a multiple hanging drop assay, „Australian Journal of Plant Physiology”, 12 (2), 1985, s. 201–211, DOI: 10.1071/PP9850201 (ang.).
- ↑ a b c d e f g h Andrzej Bajguz, Elżbieta Tryniszewska. Andrzej. „Studies in Natural Products Chemistry”, s. 33-49, 2013. Elsevier. (ang.).
- ↑ Jana Malikova, Jana Swaczynowa. Anticancer and antiproliferative activity of natural brassinosteroids. „Phytochemistry”. 2 (69), s. 418-426, 2008. Elsevier. DOI: 10.1016/j.phytochem.2007.07.028. (ang.).
- ↑ Monica Waschsman, Elsa Lopez. Antiviral effect of brassinosteroids against herpes virus and arenaviruses. „Antiviral Chemistry & Chemotherapy”. s. 71-77. (ang.).
- ↑ Sukhmeen Kaur Kohli, Bhardawaj Abhay. Therapeutic Potential of Brassinosteroids in Biomedical and Clinical Research. „Biomolecules”. 4 (10), 2020. DOI: 10.3390/biom10040572. (ang.).
- ↑ Adaucto Ballarmino Pereira-Netto: Brassinosteroids: Practical Applications in Agriculture and Human Health. Brazylia: 2012, s. 72-83. ISBN 978-1-60805-298-1.
- ↑ Debora Esposito, Barbara Schmidt. Acceleration of cutaneous wound healing by brassinosteroids. „Wound Repair Regen”, s. 688-696, 2013. (ang.).
- ↑ P.J. Jones, T. Howell. Short-term administration of tall oil phytosterols improves plasma lipid profiles in subjects with different cholesterol levels. „Metabolism”. 5 (47), s. 751-756, 1998. DOI: 10.1016/s0026-0495(98)90041-5.. (ang.).
- ↑ Jennifer Scholle, William Baker. The effect of adding plant sterols or stanols to statin therapy in hypercholesterolemic patients: systematic review and meta-analysis. „Journal of the American College of Nutrition”. 5 (28). s. 517-524. DOI: 10.1080/07315724.2009.10719784. (ang.).
