Czerniak błon śluzowych
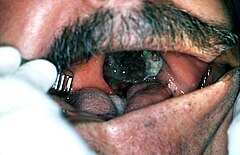 Czerniak w obrębie błony śluzowej podniebienia twardego | |
| Klasyfikacje | |
| ICD-10 |
C43.9 |
|---|---|
Czerniak błon śluzowych – rzadki nowotwór złośliwy wywodzący się z melanocytów pojawiający się w obrębie błony śluzowej jamy ustnej, przewodu pokarmowego, w szczególności w odbytnicy, oraz układu moczowo-płciowego. Jest to trzecia co do częstości po skórze i oku lokalizacja czerniaka. Czerniak błon śluzowych jest osobnym podtypem czerniaka o odrębnej patogenezie, rokowaniu i leczeniu.
Epidemiologia[edytuj | edytuj kod]
Czerniak błon śluzowych w przeciwieństwie do czerniaka skóry jest rzadkim nowotworem. Stanowi on tylko 1,4% wszystkich przypadków czerniaka[1][2]. Zapadalność na czerniaka błon śluzowych w USA wynosi 2,2 na 1 000 000[1]. Częściej chorują kobiety ze względu na znaczny odsetek czerniaka w obrębie układu moczowo-płciowego, który stanowi aż 60% przypadków czerniaka błon śluzowych u kobiet. Nie obserwuje się różnic zapadalności pomiędzy kobietami i mężczyznami w lokalizacjach poza układem moczowo-płciowym[1].
Zapadalność na chorobę rośnie z wiekiem, 65% chorych skończyło 65. rok życia[1]. Średni wiek zachorowania wynosi około 67 rok życia, co jest o 12 lat mniej niż w czerniaku skóry[1][2]. Podobnie do czerniaka skóry częściej chorują osoby rasy białej niż czarnoskóre[1].
Czynniki ryzyka[edytuj | edytuj kod]
Nie są znane czynniki ryzyka choroby. Ekspozycja na działanie światła słonecznego i promieniowanie UV prawdopodobnie nie jest czynnikiem ryzyka. Również nie wykazano związku z zakażeniem wirusem brodawczaka ludzkiego i wirusem opryszczki[3][4][1].
Lokalizacja i objawy[edytuj | edytuj kod]
Czerniak błony śluzowej przewodu pokarmowego[edytuj | edytuj kod]
Czerniak może się pojawić w każdym odcinku błony śluzowej przewodu pokarmowego. Najczęściej jest zlokalizowany w obrębie odbytnicy (22% czerniaków błony śluzowej przewodu pokarmowego) i kanału odbytu (32%) oraz jamy ustnej (33%). Znacznie rzadziej pojawia się w obrębie przełyku, żołądka, jelita cienkiego, pęcherzyka żółciowego i jelita grubego. Ponad połowa chorych ma powyżej 70 lat, tylko 15% jest w wieku poniżej 50 lat[1].
- Czerniak jamy ustnej i gardła
Stanowi około 33% czerniaków błony śluzowej. Zwykle pojawia się de novo bez poprzedzających łagodnych zmian melanocytowych. Najczęstszymi lokalizacjami są podniebienie twarde i dziąsło szczęki, rzadziej dziąsło żuchwy, wargi i policzki. Wyjątkowo rzadko dotyczy dna jamy ustnej, migdałków i ślinianki przyusznej[1].
Początkowo czerniak pozostaje bezobjawowy, później jest to płaska zmiana o charakterze plamki lub jest nieznacznie uniesiona, wykwit cechuje się nieregularnym zabarwieniem[1]. Zmiana może przybierać kolor brązowy i czarny, również białoszary, fioletowy i czerwony[5]. Zmiany bezbarwne mogą występować do jednej trzeciej przypadków[5]. W późniejszym etapie zmiany ulegają uniesieniu, pojawiają się obrzęk, owrzodzenie, krwawienie i ból. Wokół zmiany mogą występować zmiany satelitarne. U co czwartego chorego w momencie rozpoznania stwierdza się przerzuty do węzłów chłonnych[1].
- Czerniak przełyku

Stanowi około 5% lokalizacji czerniaka błon śluzowych przewodu pokarmowego i tylko 0,1-0,2% nowotworów przełyków[6]. Większość guzów jest zlokalizowana w dwóch trzecich dolnej części przełyku, tylko 10% z nich lokalizuje się w jednej trzeciej górnej części przełyku[1].
Głównym objawem są zaburzenia połykania, ból zamostkowy i utrata masy ciała, rzadziej pojawiają się krwawe wymioty i smoliste stolce. W endoskopii jest widoczny jako uniesiona, zabarwiona zmiana, czasem z owrzodzeniem lub obecnością zmian satelitarnych. W 10-25% guz jest bezbarwny[1].
- Czerniak żołądka
Jest to bardzo rzadka lokalizacja. Nie wykazano obecności melanocytów w nabłonku żołądka i pochodzenie nowotworu jest niejasne. Podobnie jak inne nowotwory żołądka guz objawia się niespecyficznymi objawami takimi jak ból brzucha, utrata masy ciała, krwawienie z przewodu pokarmowego i niedokrwistość[1].
- Czerniak jelita cienkiego
Jest to bardzo rzadka lokalizacja czerniaka błony śluzowej, a wielokrotnie częściej obserwuje się przerzuty czerniaka skóry. Pochodzenie nowotworu jest niejasne ze względu na niewykazanie obecności melanocytów w nabłonku błony śluzowej jelita cienkiego. Podobnie jak inne nowotwory jelita cienkiego guz nie daje specyficznych objawów, stwierdza się utratę masy ciała, ból brzucha, krwawienie do przewodu pokarmowego i niedrożność jelit. Najczęściej jest zlokalizowany w obrębie jelita krętego. Zwykle w momencie rozpoznania stwierdza się przerzuty do węzłów krezkowych[1].
- Czerniak dróg żółciowych i pęcherzyka żółciowego
Czerniak dróg żółciowych i pęcherzyka żółciowego jest bardzo rzadką lokalizacją czerniaka błon śluzowych. Objawy przypominają kamicę pęcherzyka żółciowego lub kamicę przewodową i obejmują ból w prawym podżebrzu i żółtaczkę[1].
- Czerniak odbytnicy i kanału odbytu

Jest to najczęstsza lokalizacja czerniaka błony śluzowej przewodu pokarmowego. Czerniak okolicy odbytniczo-odbytowej stanowi 16,5% wszystkich czerniaków błony śluzowej. Nowotwór najczęściej dotyczy osób w wieku 65-70 lat, częściej kobiet. Może występować w odbytnicy lub kanale odbytu, jednak większość guzów jest zlokalizowana w odległości około 6 cm od krawędzi odbytu[1].
Nowotwór najczęściej objawia się krwawieniem, bólem lub odczuciem dyskomfortu i wypadaniem guza przez szparę odbytu. Czerniak przyjmuje formę polipowatą, może być zabarwiony lub bezbarwny, czasem obecne jest owrzodzenie. W momencie rozpoznania u 33% chorych obecne są przerzuty do lokalnych węzłów chłonnych[1].
- Czerniak jelita grubego
Zajęcie jelita grubego poza odbytnicą jest bardzo rzadkie. Najczęściej pojawia się po prawej stronie okrężnicy i w kątnicy. Głównym objawem jest ból i krwawienie[1].
Czerniak błony śluzowej układu moczowo-płciowego[edytuj | edytuj kod]
Czerniak może się pojawić w każdej lokalizacji w układzie płciowym i moczowym. Zdecydowana większość czerniaków błony śluzowej lokalizuje się w obrębie sromu, pochwy, a rzadziej w pęcherzu moczowym i cewce moczowej. Pozostałe umiejscowienia są bardzo rzadkie[1].
- Czerniak sromu
Czerniak jest drugim co do częstości po raku płaskonabłonkowym nowotworem złośliwym w tej lokalizacji. Stanowi 76% wszystkich czerniaków błony śluzowej układu moczowo-płciowego. Mimo że obejmuje również nowotwory powstałe w obrębie skóry, to ze względu na ciągłość błony śluzowej i etiologię niezwiązaną z promieniowaniem ultrafioletowym jest zaliczany do czerniaków błon śluzowych, a nie skóry[1].
Chorują głównie starsze kobiety, mediana zachorowania przypada na 68. rok życia. Najczęściej jest zlokalizowany w okolicy łechtaczki, w obrębie warg sromowych większych, następnie warg sromowych mniejszych, okolicy ujścia cewki moczowej, a najrzadziej w okolicy ujścia pochwy. W 20% jest to zmiana wieloogniskowa z guzkami satelitarnymi[1].
Nowotwór objawia się jako krwawiący guz sromu, może występować świąd, ból lub podrażnienie błony śluzowej. Możliwy jest ból lub dyskomfort podczas oddawania moczu. Nowotwór może być bezbarwny[1].
- Czerniak pochwy
Stanowi blisko 20% czerniaków błony śluzowej układu moczowo-płciowego, ale tylko około 3% nowotworów złośliwych pochwy. Chorują głównie starsze kobiety, mediana wieku zachorowania wynosi 60 lat[7]. Nowotwór zwykle jest zlokalizowany na przedniej ścianie w jednej trzeciej dolnej części pochwy[1].
Nowotwór objawia się krwawieniem z pochwy, upławami (nieprawidłowa wydzielina z pochwy), obecnością guza w pochwie, rzadziej bólem. W badaniu ginekologicznym we wziernikach jest widoczny jako kruchy, łatwo krwawiący guz o różnym stopniu zabarwienia. Zmiany bezbarwne są rzadkie, ale mogą być mylone z innymi nowotworami. Często występuje owrzodzenie zmiany. W 20% przypadków choroba jest wieloogniskowa[1].
- Czerniak szyjki macicy
Jest to rzadka lokalizacja czerniaka. Większość chorych ukończyła 50. rok życia. Guz objawia się nieprawidłowym krwawieniem i upławami. W badaniu ginekologicznym zwykle jest to zabarwiony guz, choć możliwe są postacie bezbarwne[1].
- Czerniak pęcherza moczowego
Jest to bardzo rzadki nowotwór i opisano tylko kilkadziesiąt przypadków tej choroby. W zaawansowanym stadium objawia się krwiomoczem oraz bolesnym oddawaniem moczu[1].
- Czerniak cewki moczowej
Jest to bardzo rzadki nowotwór, stanowi około 4% nowotworów cewki moczowej. Najczęściej występuje u kobiet w starszym wieku. W większości przypadków zajmuje końcowy odcinek cewki moczowej. W 20% przypadków jest to guz bezbarwny[1].
Czerniak błony śluzowej układu oddechowego[edytuj | edytuj kod]
W obrębie dróg oddechowych najczęstszą lokalizacją jest jama nosowa i zatoki oboczne, lokalizacja w krtani, drzewie oskrzelowym i płucach jest znacznie rzadsza.
- Czerniak jamy nosowej i zatok obocznych
Czerniak jamy nosowej i zatok obocznych jest rzadkim nowotworem i stanowi tylko 4% nowotworów jamy nosowej i zatok obocznych. Guzy są zlokalizowane przede wszystkim w jamie nosowej, najczęściej w obrębie przegrody nosowej i bocznych ścianach jamy nosowej. W zatokach najczęściej dotyczą zatoki szczękowej i komórek sitowych[1].
Do głównych objawów nowotworu należy niedrożność nosa, krwawienie z nosa i stwierdzenie masy guza w obrębie nosa. W stadium zaawansowanym powoduje dolegliwości bólowe, zniekształcenie twarzy i zaburzenia widzenia[1].
- Czerniak krtani
Jest to bardzo rzadki nowotwór. W 80% przypadków dotyczy starszych mężczyzn. Objawia się chrypką i podrażnieniem gardła, później pojawiają się ból gardła, zaburzenia połykania i obrzęk szyi[1].
- Czerniak płuc
Jest to bardzo rzadki nowotwór, ze względu na wielokrotnie częstsze występowanie przerzutów w tej lokalizacji niż pierwotnego czerniaka rozpoznanie jest bardzo trudne. Objawy są podobne do raka płuc i obejmują głównie kaszel, krwioplucie i płatowe zapalenie płuc. Może być rozpoznany przypadkowo podczas wykonania badania radiologicznego przeprowadzonego z innego powodu niż podejrzenie choroby nowotworowej[1].
Rozpoznanie[edytuj | edytuj kod]

Ze względu na brak wczesnych objawów oraz ukryte lokalizacje guzów rozpoznanie choroby zwykle jest znacznie opóźnione i czerniaka stwierdza się na etapie zaawansowanym. Ostateczne rozpoznanie stawia się na podstawie badania histopatologicznego, w którym pomocne jest badanie immunohistochemiczne. Kluczowe jest odróżnienie czerniaka błon śluzowych od przerzutów znacznie częstszego czerniaka skóry, a także przerzutów czerniaka oka. Dodatkowe utrudnienie stanowi stosunkowo częsty problem z lokalizacją guza pierwotnego czerniaka skóry oraz możliwość regresji guza pierwotnego[1].
Leczenie[edytuj | edytuj kod]
Podstawą leczenia czerniaka błon śluzowych jest chirurgiczna resekcja guza z odpowiednio szerokim marginesem zdrowych tkanek. Jednocześnie jest to jedyna metoda pozwalająca na całkowite wyleczenie z choroby. Leczenie chirurgiczne jest również ważne w lokalnej kontroli choroby[2][8].
W większości przypadków w momencie rozpoznania są obecne mikroprzerzuty, jednak nie przeprowadzono badań oceniających leczenie adiuwantowe (uzupełniające) po chirurgicznym wycięciu guza. Mimo to zwykle po zabiegu chirurgicznym przeprowadza się adiuwantową radioterapię. Nie ma badań oceniających skuteczność leczenia interferonem alfa, jednak jest on stosowany w leczeniu uzupełniającym[2].
W patogenezie czerniaka biorą udział mechanizmy pozwalające uniknąć rozpoznania przez układ immunologiczny. W leczeniu czerniaka skóry wykorzystuje się przeciwciała monoklonalne przeciw CTLA-4 oraz receptorowi programowanej śmierci PD-1[9].
CTLA-4 jest fizjologicznym białkiem regulującym w dół odpowiedź immunologiczną zapobiegając nadmiernej odpowiedzi immunologicznej. Wykazano, że w mikrośrodowisku guza nowotworowego występuje niska odpowiedź przeciwnowotworowa i prawdopodobnie nowotwór wykorzystuje CTLA-4 do tłumienia odpowiedzi immunologicznej[10]. W leczeniu czerniaka błon śluzowych oceniono ipilimumab, który jest wykorzystywany w leczeniu czerniaka skóry[9]. W badaniu retrospektywnym na 33 chorych mediana przeżycia chorych leczonych ipilimumabem wynosiła 6,4 miesiąca[11]. W badaniu na 71 chorych z przerzutowym czerniakiem błon śluzowych zaobserwowano 12% odsetek odpowiedzi i 36% odsetek immunologicznej kontroli choroby. Mediana czasu wolnego od progresji choroby (PFS) wynosiła 4,3 miesięcy, a mediana przeżycia całkowitego 6,4 miesięcy[12].
Receptor programowanej śmierci PD-1 odpowiada za redukcje nadmiernej aktywacji limfocytów T i odpowiedzi immunologicznej. Przeciwciała przeciw PD-1 pembrolizumab i niwolumab są stosowane w leczeniu czerniaka skóry, jednak nie przeprowadzono odpowiednich badań oceniających ich skuteczność w leczeniu czerniaka błon śluzowych[9].
Mutacja genu kinazy tyrozynowej c-KIT występuje w 20-40% przypadków czerniaka błon śluzowych[13][14]. Skutecznym lekiem w leczeniu aktywującej mutacji c-KIT jest imatynib. Badania przedkliniczne wskazują na skuteczność leczenia imatynibem w przypadku mutacji aktywującej c-KIT[15][16][17]. W badaniach przedklinicznych lek osiągnął 35% odsetek odpowiedzi obiektywnych, choć czas trwania kontroli czerniaka pozostawał krótki[18].
Ewerolimus jest inhibitorem kinazy mTOR. Kilka małych badań wskazuje na potencjalną przydatność tego leku w leczeniu przerzutowego czerniaka błon śluzowych[19][20][9]. Do tej pory nie opublikowano badań oceniających skuteczność inhibitorów BRAF (wemurafenib, dabrafenib) lub MEK (trametinib, selumetinib) w leczeniu przerzutowego czerniaka błon śluzowych, również częstość tych mutacji jest niższa w porównaniu do czerniaka skóry[9].
Również nie przeprowadzono badań oceniających skuteczność klasycznej chemioterapii w leczeniu czerniaka błon śluzowych. Stosuje się leki wykorzystywane w leczeniu czerniaka skóry. Wykorzystuje się dakarbazynę, temozolomid, połączenie dakarbazyny, cisplatyny, karmustyny i tamoksyfenu (schemat Dartmouth)[21][22], połączenie paklitakselu z karboplatyną (PC)[23][9], a także biochemioterapię z IL-2 i INF-alfa[2].
Rokowanie[edytuj | edytuj kod]
Rokowanie ze względu na późne rozpoznanie zwykle jest złe. Przeżycia pięcioletnie osiąga około 25% leczonych[1].
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah M. Mihajlovic, S. Vlajkovic, P. Jovanovic, V. Stefanovic. Primary mucosal melanomas: a comprehensive review. „Int J Clin Exp Pathol”. 5 (8), s. 739-53, 2012. PMID: 23071856.
- ↑ a b c d e N. Seetharamu, PA. Ott, AC. Pavlick. Mucosal melanomas: a case-based review of the literature.. „Oncologist”. 15 (7), s. 772-81, 2010. DOI: 10.1634/theoncologist.2010-0067. PMID: 20571149.
- ↑ L. Dahlgren, K. Schedvins, L. Kanter-Lewensohn, T. Dalianis i inni. Human papilloma virus (HPV) is rarely detected in malignant melanomas of sun sheltered mucosal membranes. „Acta Oncol”. 44 (7), s. 694-9, 2005. DOI: 10.1080/02841860500247461. PMID: 16227159.
- ↑ R. Lundberg, M. Brytting, L. Dahlgren, L. Kanter-Lewensohn i inni. Human herpes virus DNA is rarely detected in non-UV light-associated primary malignant melanomas of mucous membranes. „Anticancer Res”. 26 (5B). s. 3627-31. PMID: 17094377.
- ↑ a b O. Warszawik-Hendzel, M. Słowińska, M. Olszewska, L. Rudnicka. Melanoma of the oral cavity: pathogenesis, dermoscopy, clinical features, staging and management.. „J Dermatol Case Rep”. 8 (3), s. 60-6, Sep 2014. DOI: 10.3315/jdcr.2014.1175. PMID: 25324906.
- ↑ M. Bisceglia, F. Perri, A. Tucci, M. Tardio i inni. Primary malignant melanoma of the esophagus: a clinicopathologic study of a case with comprehensive literature review. „Adv Anat Pathol”. 18 (3), s. 235-52, May 2011. DOI: 10.1097/PAP.0b013e318216b99b. PMID: 21490441.
- ↑ M. Frumovitz, M. Etchepareborda, CC. Sun, PT. Soliman i inni. Primary malignant melanoma of the vagina. „Obstet Gynecol”. 116 (6), s. 1358-65, Dec 2010. DOI: 10.1097/AOG.0b013e3181fb8045. PMID: 21099603.
- ↑ DeVita, Lawrence i Rosenberg 2008 ↓, s. 1920.
- ↑ a b c d e f X. Wang, L. Si, J. Guo. Treatment algorithm of metastatic mucosal melanoma.. „Chin Clin Oncol”. 3 (3), s. 38, Sep 2014. DOI: 10.3978/j.issn.2304-3865.2014.08.04. PMID: 25841464.
- ↑ C. Wei, S. Sirikanjanapong, S. Lieberman, M. Delacure i inni. Primary mucosal melanoma arising from the eustachian tube with CTLA-4, IL-17A, IL-17C, and IL-17E upregulation. „Ear Nose Throat J”. 92 (1), s. 36-40, Jan 2013. PMID: 23354891.
- ↑ MA. Postow, JJ. Luke, MJ. Bluth, N. Ramaiya i inni. Ipilimumab for patients with advanced mucosal melanoma. „Oncologist”. 18 (6), s. 726-32, Jun 2013. DOI: 10.1634/theoncologist.2012-0464. PMID: 23716015.
- ↑ M. Del Vecchio, L. Di Guardo, PA. Ascierto, AM. Grimaldi i inni. Efficacy and safety of ipilimumab 3mg/kg in patients with pretreated, metastatic, mucosal melanoma. „Eur J Cancer”. 50 (1), s. 121-7, Jan 2014. DOI: 10.1016/j.ejca.2013.09.007. PMID: 24100024.
- ↑ JA. Curtin, K. Busam, D. Pinkel, BC. Bastian. Somatic activation of KIT in distinct subtypes of melanoma. „J Clin Oncol”. 24 (26), s. 4340-6, Sep 2006. DOI: 10.1200/JCO.2006.06.2984. PMID: 16908931.
- ↑ MS. Carlino, JR. Todd, H. Rizos. Resistance to c-Kit inhibitors in melanoma: insights for future therapies. „Oncoscience”. 1 (6), s. 423-6, 2014. PMID: 25594040.
- ↑ FS. Hodi, P. Friedlander, CL. Corless, MC. Heinrich i inni. Major response to imatinib mesylate in KIT-mutated melanoma. „J Clin Oncol”. 26 (12), s. 2046-51, Apr 2008. DOI: 10.1200/JCO.2007.14.0707. PMID: 18421059.
- ↑ J. Lutzky, J. Bauer, BC. Bastian. Dose-dependent, complete response to imatinib of a metastatic mucosal melanoma with a K642E KIT mutation. „Pigment Cell Melanoma Res”. 21 (4), s. 492-3, Aug 2008. DOI: 10.1111/j.1755-148X.2008.00475.x. PMID: 18510589.
- ↑ X. Jiang, J. Zhou, NK. Yuen, CL. Corless i inni. Imatinib targeting of KIT-mutant oncoprotein in melanoma. „Clin Cancer Res”. 14 (23), s. 7726-32, Dec 2008. DOI: 10.1158/1078-0432.CCR-08-1144. PMID: 19047099.
- ↑ KB. Kim, A. Alrwas. Treatment of KIT-mutated metastatic mucosal melanoma. „Chin Clin Oncol”. 3 (3), s. 35, Sep 2014. DOI: 10.3978/j.issn.2304-3865.2014.08.02. PMID: 25841461.
- ↑ SN. Markovic, VJ. Suman, JN. Ingle, JS. Kaur i inni. Peptide vaccination of patients with metastatic melanoma: improved clinical outcome in patients demonstrating effective immunization. „Am J Clin Oncol”. 29 (4), s. 352-60, Aug 2006. DOI: 10.1097/01.coc.0000217877.78473.a4. PMID: 16891861.
- ↑ L. Si, X. Xu, Y. Kong, KT. Flaherty i inni. Major response to everolimus in melanoma with acquired imatinib resistance. „J Clin Oncol”. 30 (4), s. e37-40, Feb 2012. DOI: 10.1200/JCO.2011.37.9644. PMID: 22162580.
- ↑ SC. Lattanzi, T. Tosteson, J. Chertoff, LH. Maurer i inni. Dacarbazine, cisplatin and carmustine, with or without tamoxifen, for metastatic melanoma: 5-year follow-up. „Melanoma Res”. 5 (5), s. 365-9, Oct 1995. PMID: 8541728.
- ↑ HI. Saba, CW. Cruse, KE. Wells, CJ. Klein i inni. Treatment of stage IV malignant melanoma with dacarbazine, carmustine, cisplatin, and tamoxifen regimens: a University of South Florida and H. Lee Moffitt Melanoma Center Study. „Ann Plast Surg”. 28 (1), s. 65-9, Jan 1992. PMID: 1642409.
- ↑ W. Chang, SJ. Lee, S. Park, MK. Choi i inni. Effect of paclitaxel/carboplatin salvage chemotherapy in noncutaneous versus cutaneous metastatic melanoma. „Melanoma Res”. 23 (2), s. 147-51, Apr 2013. DOI: 10.1097/CMR.0b013e32835efd8d. PMID: 23411477.
Bibliografia[edytuj | edytuj kod]
- Vincent T. DeVita, Theodore S. Lawrence, Steven A. Rosenberg: Devita, Hellman & Rosenberg's Cancer: Principles & Practice of Oncology. Wyd. 8. Lippincott Williams & Wilkins, 2008. ISBN 978-0-7817-7207-5.
