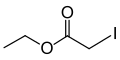
Jodooctan etylu
| |||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C4H7IO2 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
ICH2COOC2H5 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa molowa |
214,00 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
oleista ciecz[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki |
chlorooctan etylu, bromooctan etylu, fluorooctan etylu, jodooctan metylu, octan etylu | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||
Jodooctan etylu (SK, KSK[a]) – organiczny związek chemiczny, ester etylowy kwasu jodooctowego. Był jednym z najsilniejszych bojowych środków trujących z grupy lakrymatorów stosowanych w czasie I wojny światowej[6].
Otrzymywanie[edytuj | edytuj kod]
Jodooctan etylu można otrzymać po dodaniu stałego jodku potasu do alkoholowego roztworu bromooctanu etylu[7][8]. Otrzymanie jodooctanu etylu w sposób analogiczny do chlorooctanu i bromooctanu etylu – poprzez estryfikację kwasu jodooctowego etanolem uważane było dawniej za niemożliwe[7], jednak obecnie synteza taka jest opisana (reakcja w benzenie w obecności stężonego kwasu siarkowego)[9], podobnie jak estryfikacje kwasu jodooctowego innymi alkoholami[10].
Właściwości[edytuj | edytuj kod]
Jest to bezbarwna, oleista ciecz o małej lotności. Rozkłada się pod wpływem światła i powietrza, jak również przy długim przechowywaniu, zmieniając barwę na brązową w wyniku uwalniania jodu[3][6]. Bardzo wolno rozkłada się pod wpływem wody i roztworów zasadowych (nieco szybciej przy jednoczesnym ogrzewaniu)[7]:
- ICH2COOC2H5 + 2NaOH → NaI + HOCH2COONa + C2H5OH
Jodooctan etylu łatwo reaguje z tiosiarczanem sodu. Jest także całkowicie rozkładany przez ogrzewanie z kwasem azotowym[7].
W celu zwiększenia lotności jodooctanu etylu stosowano go jako mieszaninę z etanolem i octanem etylu. Mieszanina ta, oznaczana skrótem KSK[a], zawierała 70% jodooctanu etylu i 30% etanolu z octanem etylu[3][11]. Stosowana była także mieszanina z chloropikryną (90% jodooctanu etylu i 10% chloropikryny)[3][6].
Zagrożenia[edytuj | edytuj kod]
Jodooctan etylu jest lakrymatorem działającym łzawiąco od stężenia 1,4 mg/m³ i toksycznie – 1,5 g/m³ przy 10-minutowej ekspozycji. W kontakcie z oczami powoduje silny ból. Ogólna toksyczność jest ok. 3 razy mniejsza od fosgenu. Z powodu małej lotności, działanie silnie toksyczne jest mało prawdopodobne przy zastosowaniu w otwartym terenie[6].
Jodooctan etylu jest silnym inhibitorem dwóch enzymów z klasy oksydoreduktaz zawierających grupy tiolowe – dehydrogenazy bursztynianowej (EC 1.3.99.1) i oksydazy pirogronianowej (EC 1.2.3.3). Natomiast dehydrogenaza mleczanowa (EC 1.1.1.27) jest całkowicie niewrażliwa na tę substancję[12].
LCt50 wynosi 15 000 mg·min/m³ (860 ppm przy 2-minutowym narażeniu)[3]. W przeglądzie z 1934 roku odnotowano dwa przypadki śmiertelne związane z narażeniem na jodooctan etylu. W pierwszym z nich ofiarą był robotnik wystawiony na działanie tej substancji po wybuchu pocisku, a w drugim – moździerzysta po przedwczesnym wybuchu pocisku[13].
Historia[edytuj | edytuj kod]
Po raz pierwszy otrzymany został przez Williama Henry’ego Perkina i Baldwina Francisa Duppę w 1859 roku w reakcji bromooctanu etylu z jodkiem potasu[7][14]. Na początku I wojny światowej jodooctan etylu testowany był przez Brytyjczyków, a w styczniu 1915 roku chemicy z Imperial College London (mieszczącego się w londyńskiej dzielnicy South Kensington – stąd oznaczenie SK[6]) zademonstrowali działanie tego środka bezpośrednio na przedstawicielu Ministerstwa Wojny[15][16].
Został po raz pierwszy użyty 24 września 1915 roku przez Brytyjczyków w bitwie pod Loos[16]. Mimo wyższej ceny jodu w porównaniu do bromu i chloru, był on wykorzystywany do produkcji broni chemicznej z powodu malejących dostaw bromu, podczas gdy jod sprowadzany był w dużych ilościach z Afryki południowej. Roztwory jodooctanu etylu (także w mieszaninie z chloropikryną) m.in. w alkoholu i octanie etylu stosowane były w pociskach haubicznych kal. 4,2″ i w pociskach do moździerzy Stokesa kal. 4″[17]. W 1926 roku wznowiono produkcję jodooctanu etylu w Imperial Chemical Industries[18].
Uwagi[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ a b c d David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 3-246, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b c d e Jodooctan etylu (nr 242934) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2011-04-22]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e f g Irritating and Lachrymatory Agents C13-A, [w:] D. Hank Ellison, Handbook of Chemical and Biological Warfare Agents, wyd. 2, Boca Raton: CRC Press, 2008, s. 417–418, ISBN 978-0-8493-1434-6 (ang.).Związek C13-A012.
- ↑ a b c Ethyl iodoacetate, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2011-04-22] (ang.).
- ↑ Jodooctan etylu (nr 242934) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2011-04-22]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e Chemical Warfare Agents. Toxicology and Treatment, Timothy C. Marrs (red.), Robert L. Maynard (red.), Frederick R. Sidell (red.), wyd. 2, John Wiley & Sons, 2007, s. 682, ISBN 978-0-470-01359-5 (ang.).
- ↑ a b c d e Halogenated Esters of Organic Acids. W: Mario Sartori: The War Gases. Chemistry and Analysis. Nowy Jork: Van Nostrand, 1939, s. 121–122. OCLC 2363679.
- ↑ Sidney A. Katz, Harry Salem: Synthesis and Chemical Analysis of Riot Control Agents. W: Riot Control Agents. Issues in toxicology, safety, and health. Eugene J. Olajos, Woodhall Stopford (red.). Boca Raton: CRC Press, 2004, s. 32. ISBN 0-415-29902-0.
- ↑ Catherine Maury, Jean Petrissans. Analyse structurale des dérivés fonctionnels des acides carboxyliques Partie III. Acétate d’éthyle, dérivés α-halogénés. „J. Mol. Struct.”. 249 (2–4), s. 221–232, 1991. DOI: 10.1016/0022-2860(91)85069-F. (fr.).
- ↑ Wynik wyszukiwania reakcji CIH2COOH + ROH w bazie reaxys.
- ↑ Chemical Warfare Agents. Toxicology and Treatment, Timothy C. Marrs (red.), Robert L. Maynard (red.), Frederick R. Sidell (red.), wyd. 2, John Wiley & Sons, 2007, s. 688, ISBN 978-0-470-01359-5 (ang.).
- ↑ Corey J. Hilmas i inni, Riot Control Agents, [w:] Handbook of Toxicology of Chemical Warfare Agents, Ramesh C. Gupta (red.), wyd. 1, Elsevier, 2009, s. 159, ISBN 978-0-12-374484-5.
- ↑ Kirby E. Jackson, Margaret Arthur Jackson, Lachrymators, „Chemical Reviews”, 16 (2), 1935, s. 195–242, DOI: 10.1021/cr60054a003 (ang.).
- ↑ W. H. Perkin, B. F. Duppa. Ueber die Jodessigsäure. „Justus Liebigs Annalen der Chemie”. 112 (1), s. 125–127, 1859. DOI: 10.1002/jlac.18591120114.
- ↑ Początki – gazy łzawiące i drażniące dymy, [w:] Leszek Konopski, Historia broni chemicznej, Warszawa: Bellona, 2009, s. 30, ISBN 978-83-11-11643-6.
- ↑ a b Corey J. Hilmas, Jeffery K. Smart, Benjamin A. Hill, History of Chemical Warfare, [w:] Medical Aspects of Chemical Warfare, Shirley D. Tuorinsky (red.), Falls Church–Washington: Office of the Surgeon General, U.S. Army–Borden Institute, Walter Reed Army Medical Center, 2008, s. 13, 38, ISBN 978-0-16-081532-4, OCLC 460938576 [zarchiwizowane z adresu 2016-12-01] (ang.).
- ↑ Eric Croddy, Clarisa Perez-Armendariz, John Hart: Chemical and Biological Warfare: A Comprehensive Survey for the Concerned Citizen. Nowy Jork: Springer, 2002, s. 120. ISBN 978-0-387-95076-1.
- ↑ Dwudziestolecie międzywojenne (1918–1939), [w:] Leszek Konopski, Historia broni chemicznej, Warszawa: Bellona, 2009, s. 64, ISBN 978-83-11-11643-6.