Jon hydroniowy
| |||||||||||||
 Powierzchnia potencjału elektrycznego | |||||||||||||
| |||||||||||||
| Ogólne informacje | |||||||||||||
| Wzór sumaryczny |
H3O+ | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
19,02 g/mol | ||||||||||||
| Identyfikacja | |||||||||||||
| Numer CAS | |||||||||||||
| PubChem | |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||
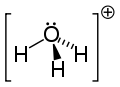
Jon hydroniowy (jon hydronowy) − najprostszy jon oksoniowy. Jest to uwodniony kation wodorowy H3O+[1][2].
W roztworach wodnych powstaje w wyniku autodysocjacji wody: 2H2O ⇌ H3O+ + OH− oraz w wyniku dysocjacji kwasów, następnie ulega dalszej hydratacji. Występuje również w kryształach monohydratów mocnych kwasów (np. kwasu nadchlorowego) i superkwasów.
Jest silnym kwasem Lewisa, jego pKa = −1,7 (w 25 °C). W czystej wodzie jego stężenie wynosi 10−7mol/dm³ (25 °C), w roztworach kwasowych jest większe. Stężenie (a ściślej aktywność) jonu hydroniowego określa pH roztworów wodnych.
Literatura chemiczna używa również wyrażeń kation wodorowy oraz proton jako (w uproszczeniu) synonimów H3O+, chociaż terminy te mają odrębne znaczenia w innych kontekstach.
Struktura[edytuj | edytuj kod]
Grupa H3O+ jest izoelektronowa z amoniakiem ponieważ atom O oraz N mają taką samą liczbę elektronów. H3O+ ma geometrię piramidy o podstawie trójkąta z atomem tlenu na jednym z wierzchołków. Wiązania H−O−H tworzą kąt około 113°. Centrum masy znajduje się blisko jądra atomu tlenu. Grupa ta jest polarna (tzn. ma elektryczny moment dipolowy).
Solwatacja[edytuj | edytuj kod]
W roztworze wodnym grupa ta jest solwatowana przez molekuły wody, tworząc m.in. kation Zundela H5O+2 i kation Eigena H9O+4. Pomiary kriometryczne wskazują, że hydratowany jon ma przeciętnie wielkość odpowiadającą H3O+(H2O)6[3]. Metody ab initio w chemii kwantowej wskazują, że hydratowany proton przebywa na powierzchni klasterów wody odpowiadających średnio formule H3O+(H2O)20.
Zobacz też[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ Oxonium ions, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.O04378, ISBN 0-9678550-9-8 (ang.).
- ↑ Robert T. Morrison, Robert N. Boyd: Chemia Organiczna. T. 1. Warszawa: Wydawnictwo Naukowe PWN, 1997, s. 58-59. ISBN 83-01-04-166-8.
- ↑ Andreas A. Zavitsas. Properties of Water Solutions of Electrolytes and Nonelectrolytes. „J. Phys. Chem. B”. 105 (32), s. 7805–7817, 2001. DOI: 10.1021/jp011053l.