Odpowiedź poliklonalna limfocytów B
| Ten artykuł od 2014-04 wymaga zweryfikowania podanych informacji. |

Odpowiedzią poliklonalną limfocytów B nazywamy naturalnie występujący wariant odpowiedzi immunologicznej prezentowany przez układ odpowiedzi swoistej ssaków. Umożliwia on obronę przed patogenem polegającą na rozpoznawaniu jednego antygenu (poprzez pokrywające się fragmenty, nazywane epitopami) przez wiele różnych klonów limfocytów B.
W trakcie fizjologicznej odpowiedzi immunologicznej fragmenty patogenów (na przykład bakterii) są rozpoznawane przez układ immunologiczny jako obce (nie własne), a następnie eliminowane czy też skutecznie neutralizowane w celu ograniczenia ich potencjalnej szkodliwości. Taką rozpoznawaną substancję nazywamy antygenem. Układ immunologiczny reaguje na antygen na wiele sposobów. Kluczowym elementem takiej odpowiedzi jest produkcja przeciwciał przez limfocyty B, za którą odpowiedzialna jest jedna z gałęzi układu immunologicznego nazywana odpornością humoralną. Przeciwciała są rozpuszczalne i nie wymagają do działania bezpośredniego kontaktu pomiędzy komórką patogenu a limfocytem typu B.
Antygeny mogą być dużymi i złożonymi cząsteczkami, a pojedyncze przeciwciało wiąże się jedynie z niewielkim, określonym obszarem na powierzchni antygenu. W związku z tym skuteczna odpowiedź immunologiczna często wiąże się z produkcją przez wiele różnych limfocytów B wielu różnych przeciwciał skierowanych przeciwko jednemu antygenowi. Stąd też bierze się określenie „poliklonalna”, pochodzące od słów poli, oznaczającego wiele i klony („klon” = gr. pęd, gałąź). Klonem określamy grupę komórek wywodzących się od jednej komórki „matki”. Przeciwciała produkowane w toku odpowiedzi poliklonalnej noszą nazwę przeciwciał poliklonalnych. Heterogenne przeciwciała poliklonalne należy odróżniać od przeciwciał monoklonalnych, które są identyczne i skierowane przeciwko jednemu antygenowi, co daje im większą swoistość.
Chociaż odpowiedź poliklonalna niesie ze sobą pozytywne skutki dla układu immunologicznego, w szczególności większe prawdopodobieństwo wystąpienia reakcji przeciw patogenom, zwiększa jednak ryzyko rozwinięcia określonych chorób autoimmunologicznych, które powstają w wyniku zwrócenia się układu immunologicznego przeciwko własnym cząsteczkom produkowanym przez organizm gospodarza.
Odpowiedź humoralna skierowana przeciwko infekcji[edytuj | edytuj kod]
Choroby, które mogą być przekazywane od jednego organizmu do drugiego, określane są jako choroby zakaźne, wywołujący je czynnik biologiczny nosi zaś nazwę patogenu. Proces wejścia patogenu do organizmu nosi nazwę zakażenia, a organizm ten nazywa się gospodarzem. Osiedlenie się patogenu w organizmie gospodarza nosi nazwę kolonizacji. Może ona doprowadzić do infekcji, a w konsekwencji – do wyrządzenia szkody gospodarzowi: albo bezpośrednio przez patogen, albo przez jego toksyny. Prowadzi to do wystąpienia oznak i symptomów charakterystycznych dla chorób zakaźnych, jak zapalenie płuc czy błonica.
Przeciwstawianie się różnorakim chorobom zakaźnym jest istotne dla przetrwania: bezpośrednio – zakażonego organizmu, a pośrednio – całego gatunku. Osiąga się to poprzez eliminację patogenu i jego toksyn lub unieszkodliwianie ich. Zbiór różnorodnych komórek, tkanek i narządów, które są wyspecjalizowane w ochronie organizmu przed infekcjami, nosi nazwę układu immunologicznego. Ochrona przed infekcjami może przybierać różne formy. Jedną z nich jest bezpośredni kontakt niektórych leukocytów z dokonującymi inwazji patogenami angażującymi jedną z gałęzi układu immunologicznego określaną jako układ odporności komórkowej. Inną formą aktywności układu immunologicznego jest produkcja substancji, które przemieszczają się w kierunku miejsca infekcji, „odszukują” komórki i toksyny wywołujące chorobę, wiążąc się z nimi i neutralizując je. Cały proces określa się mianem odpowiedzi humoralnej, która stanowi drugą z gałęzi układu immunologicznego, a biorące w nim udział substancje noszą nazwę rozpuszczalnych przeciwciał i pełnią ważne funkcje w walce z infekcją.
- Rodzaje leukocytów (White Blood Cells — WBCs)
-
Neutrofile
-
Eozynofile
-
Bazofile
-
Limfocyty
-
Monocyty
-
Makrofagi
Odpowiedź limfocytów B[edytuj | edytuj kod]

Przeciwciała pełnią różnorodne funkcje w zakresie ochrony gospodarza przed patogenami. Ich rozpuszczalne formy są produkowane przez komórki plazmatyczne (rodzaj leukocytów). Produkcja jest ściśle regulowana i wymaga aktywacji limfocytów B przez aktywowane limfocyt T (inny rodzaj leukocytów), co odbywa się w formie procesu sekwencyjnego. Głównymi etapami są:
- Swoiste lub nieswoiste rozpoznanie patogenu (poprzez jego antygeny),a następnie wchłonięcie go przez limfocyty B lub makrofagi. Limfocyty B ulegają wskutek tego jedynie częściowej aktywacji.
- Przetwarzanie antygenu
- Prezentacja antygenu
- Aktywacja limfocytów T pomocniczych przez komórki prezentujące antygen
- Kostymulacja limfocytów B przez aktywowane limfocyty T pomocnicze prowadząca do pełnej aktywacji
- Proliferacja limfocytów B i produkcja rozpuszczalnych przeciwciał

Rozpoznanie patogenów[edytuj | edytuj kod]
Patogeny syntetyzują białka, które mogą odgrywać rolę „rozpoznawalnych” antygenów; mogą eksprymować cząsteczki na swojej powierzchni lub wydzielać je do otoczenia (płynów ciała). Czynnikiem wyróżniającym takie substancje jest to, że wiążą się specyficznie i dość silnie z określonymi białkami gospodarza, zwanymi przeciwciałami. Takie same przeciwciała mogą być zakotwiczone na powierzchni komórek układu immunologicznego, gdzie pełnią funkcję receptorów lub też wydzielone do krwi w formie rozpuszczalnej. Pełniące funkcję antygenów białka są stosunkowo duże w skali molekularnej, nie mogą więc ulegać rozpoznaniu jako całość. Rozpoznawane są więc ich fragmenty nazywane epitopami. Epitop styka się z niewielkim fragmentem cząsteczki przeciwciała, nazywanym paratopem. Przeciwciało związane z błoną komórkową nosi nazwę receptora limfocytu B (B cell receptor – BCR). Choć receptor limfocytu T nie zalicza się pod względem biochemicznym do klasy przeciwciał, pełni zbliżoną funkcję w takim sensie, że wiąże się w sposób swoisty z epitopami pozostającymi w kompleksie z białkami głównego układu zgodności tkankowej (MHC – major histocompatibility complex). Wiązanie pomiędzy paratopem a odpowiadającym mu antygenem ma charakter bardzo swoisty ze względów strukturalnych. Składają się na nie różne wiązania niekowalencyjne, podobnie jak przy innych rodzajach ligandów (jakichkolwiek atomów, jonów czy cząsteczek, które wiążą się z receptorem, wykazując przy tym jakiś stopień swoistości czy siły wiązania), swoistość wiązania nie wynika ze sztywnego dopasowania w rodzaju klucza i zamka, lecz wymaga raczej niewielkich zmian konformacyjnych paratopu i epitopu przy wejściu w interakcję.
Swoiste rozpoznanie epitopu przez limfocyty B[edytuj | edytuj kod]

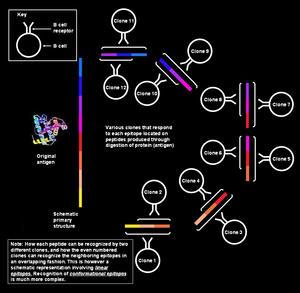
Na ilustracji po lewej stronie poszczególne segmenty tworzące epitop przedstawione są jako ułożone kolinearnie, czyli jako elementy jednej sekwencji. Jest to jednak uproszczony obraz sytuacji (rozpoznania antygenu przez limfocyt B). Epitopy, które funkcjonują w ten sposób określa się jako sekwencyjne lub liniowe, a takie rozpoznanie jest możliwe jedynie w przypadku niewielkich peptydów (o długości około sześciu-ośmiu aminokwasów) i jest wykorzystywane przez limfocyty T.
Limfocyty B (zarówno komórki naiwne, jak i pamięci) rozpoznają białko w formie natywnej na powierzchni patogenu. Mamy wtedy do czynienia ze strukturą trzeciorzędową białka i może być ono pofałdowane do tego stopnia, że pewne fragmenty białka znajdują się w jego wnętrzu, a otaczające je segmenty – na powierzchni. Aminokwasy powierzchniowe mogą być od siebie oddalone na poziomie struktury pierwszorzędowej, a stykać się ze sobą na skutek złożonych wzorów fałdowania (jak na załączonym obrazku).
W wyniku wiązania konkretnego antygenu z odpowiadającą mu cząsteczką receptora BCR następuje zwiększenie produkcji cząsteczek MHC klasy II. Wskazuje to na istotną rolę tego procesu, jako że następuje to w przypadku internalizacji antygenu poprzez stosunkowo niespecyficzny proces zwany pinocytozą, w trakcie którego antygen, wraz z otaczającymi go płytami jest „wypijany” w postaci niewielkiego pęcherzyka przez limfocyt B. Taki antygen nosi nazwę niespecyficznego i nie prowadzi do aktywacji limfocytu B ani produkcji skierowanych przeciwko sobie przeciwciał.
Nieswoiste rozpoznanie przez makrofagi[edytuj | edytuj kod]
Makrofagi i podobne komórki wykorzystują inny mechanizm rozpoznawania patogenów. Ich receptory rozpoznają określone motywy obecne u patogenów, co do których nie istnieje duże prawdopodobieństwo, że mogą występować na komórkach gospodarza. Takie powtarzalne motywy są rozpoznawane przez receptory rozpoznające wzorce molekularne (PRRs – pattern recognition receptors), jak na przykład receptory Toll-podobne (TLRs – Toll-like receptors) obecne na powierzchni makrofagów. Jako że jeden receptor może wiązać się z danym motywem na powierzchni całkiem odmiennych mikroogranizmów, taki sposób rozpoznawania patogenów jest stosunkowo niespecyficzny i jest składnikiem odpowiedzi wrodzonej.
Przetwarzanie antygenu[edytuj | edytuj kod]

Po rozpoznaniu antygenu komórka prezentująca antygen, jak na przykład makrofag czy limfocyt B, wchłania go całkowicie na drodze fagocytozy. Wchłonięta cząsteczka, wraz z częścią otaczających ją substancji, tworzy pęcherzyk endocytarny (fagosom), który ulega fuzji z lizosomem. Wewnątrz lizosomu proteazy (enzymy degradujące białka) rozbijają antygen na mniejsze fragmenty, peptydy. Peptydy tworzą potem kompleks z białkami MHC klasy II we wnętrzu lizosomu – taki sposób „radzenia sobie” z antygenem nosi nazwę egzogennego czy też endocytarnego szlaku przetwarzania antygenu, w przeciwieństwie do endogennego czy też cytozolowego, w którym nieprawidłowe białka produkowane w komórce gospodarza (na przykład pod wpływem infekcji wirusowej czy w komórce nowotworowej) tworzą kompleks z cząsteczkami MHC klasy I.
Wykazano również istnienie alternatywnego szlaku przetwarzania endocytarnego, podczas którego określone białka, takie jak fibrynogen czy mioglobina, wiążą się w całości do cząsteczek MHC klasy II po denaturacji i redukcji wiązań dwusiarczkowych (rozpadzie wiązania poprzez wstawienie atomów wodoru). Następnie proteazy degradują wyeksponowane rejony kompleksu białko – MHC klasy II.
Prezentacja antygenu[edytuj | edytuj kod]
Po utworzeniu przez przetworzony antygen (peptyd) kompleksu z MHC klasy II obydwa migrują do błony komórkowej, gdzie są eksponowane jako kompleks, który mogą rozpoznać komórki CD4+ (limfocyty T pomocnicze) – jeden z rodzajów leukocytów. Proces ten nosi nazwę prezentacji antygenu. Pewne epitopy (konformacyjne), które zostały rozpoznane przez limfocyty B przed przetworzeniem, mogą być prezentowane limfocytom T pomocniczym w innej formie. Oprócz tego limfocyt B może prezentować różne peptydy w kompleksie z różnymi cząsteczkami MHC klasy II.
Stymulacja limfocytów T pomocniczych[edytuj | edytuj kod]
Komórki CD4+ za pomocą kompleksu TCR-CD3 rozpoznają epitop związany z cząsteczką MHC klasy II na powierzchni komórek prezentujących antygen. Następnie ulegają aktywacji, proliferacji i różnicują w komórki TH2. Sprawia to, że rozpoczynają produkcję rozpuszczalnych chemicznych cząsteczek sygnałowych, które promują ich przeżywalność. Odgrywają oprócz tego jeszcze jedną rolę, a mianowicie stymulują limfocyty B poprzez bezpośredni kontakt.
Kostymulacja limfocytów B przez aktywowane limfocyty T pomocnicze[edytuj | edytuj kod]
Do pełnej stymulacji limfocytów T pomocniczych niezbędna jest obecność cząsteczki B7 na powierzchni komórki prezentującej antygen. Cząsteczka ta wiąże się z CD28 obecną na powierzchni limfocytu T (niedaleko receptora TCR). Niezbędna jest jeszcze jedna interakcja, pomiędzy ligandem CD40 albo CD154 (CD40L) na powierzchni limfocytu T i CD40 na powierzchni limfocytu B. Interakcje, które stymulują limfocyt T pomocniczy, stymulują również limfocyt B, stąd „kostymulacja”. Dzięki temu mechanizmowi, aktywowany limfocyt T pomocniczy stymuluje jedynie limfocyt B, który rozpoznaje antygen zawierający epitop rozpoznawany również przez receptor TCR „kostymulującego” limfocytu T pomocniczego. Oprócz bezpośredniej kostymulacji, limfocyt B ulega również parakrynnej stymulacji przez określone czynniki wzrostu, takie jak interleukiny 2, 4, 5 i 6. Czynniki te są produkowane głównie przez świeżo aktywowany limfocyt T pomocniczy. Aktywacja ta zachodzi jedynak tylko po związaniu odpowiedniego epitopu przez receptor BCR, bez czego nie dochodzi do wstępnych etapów odpowiedzi: fagocytozy i przetwarzania antygenu.
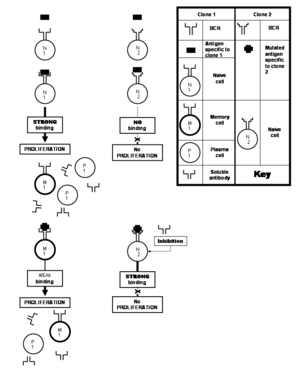
Proliferacja i różnicowanie limfocytów B[edytuj | edytuj kod]
Naiwny (dziewiczy) limfocyt B należy do klonu, który nie miał nigdy styczności z epitopem, względem którego wykazuje specyficzność. Limfocyt B pamięci, przeciwnie, jest komórką pochodzącą od aktywowanego limfocytuB – naiwnego lub pamięci. Po aktywacji limfocytu B (naiwnego lub pamięci) następuje wzmożona proliferacja konkretnej komórki, a większość komórek potomnych przekształca się w komórki plazmatyczne. Tak więc proces, w którym komórki naiwne należące do konkretnego klonu stykają się z odpowiednim antygenem, dając początek komórkom plazmatycznym i pozostawiając kilka komórek pamięci nosi nazwę odpowiedzi pierwotnej. Podczas proliferacji klonu, geny kodujące receptor BCR mogą ulegać częstym (raz na dwa podziały komórkowe) mutacjom w rejonach kodujących paratop przeciwciała. Takie częste mutacje noszą nazwę hipermutacji somatycznych. Każda mutacja zmienia w niewielkim stopniu powinowactwo paratopu do epitopu i przyczynia się do utworzenia nowego klonu limfocytu B. Niektóre nowo utworzone paratopy wiążą się z większą siłą do tego samego epitopu (prowadzi to do selekcji posiadających je klonów). Proces ten nosi nazwę dojrzewania powinowactwa. Inne paratopy wiążą się lepiej z epitopami różniącymi się nieco od pierwotnego epitopu, który zastymulował proliferację. Zróżnicowanie struktury epitopów jest zazwyczaj wynikiem mutacji w genach patogenów kodujących cząsteczki antygenów. Hipermutacje somatyczne, oprócz zwiększania powinowactwa do antygenu, który zaindukował proliferację sprawiają również, że przy kolejnych zetknięciach z antygenami receptory BCR i rozpuszczalne przeciwciała są w stanie rozpoznać szerszy zakres zmienionych epitopów. Proces, w trakcie którego komórki pamięci ulegają stymulacji przez antygen i produkują komórki plazmatyczne (podobnie, jak w przypadku odpowiedzi pierwotnej danego klonu), a także pozostawiają kolejne komórki pamięci, nazywany jest odpowiedzią wtórną. Charakteryzuje ją większa liczba komórek plazmatycznych oraz szybsza i przedłużona produkcja przeciwciał. Limfocyty B pamięci wytworzone w trakcie odpowiedzi wtórnej szybciej rozpoznają antygen i wiążą się z nim z większą siłą (czyli wiązanie charakteryzuje większe powinowactwo), co jest skutkiem dojrzewania powinowactwa. Rozpuszczalne przeciwciała produkowane przez klon cechują się podobnym wzmocnieniem wiązania antygenu.
Podstawy poliklonalności[edytuj | edytuj kod]
Odpowiedź ma naturę poliklonalną, jako że każdy klon jest na swój sposób wyspecjalizowany w produkcji przeciwciał przeciwko danemu epitopowi, a także dlatego, że każdy antygen zawiera wiele epitopów, a każdy z nich może być rozpoznawany przez więcej niż jeden klon limfocytu B. Żeby układ immunologiczny mógł odpowiadać na niezliczoną liczbę antygenów, a także na wiele tworzących je epitopów, musi być w stanie rozpoznawać olbrzymią liczbę epitopów, a co za tym idzie, niezbędna jest ogromna różnorodność klonów limfocytów B.
Klonalność limfocytów B[edytuj | edytuj kod]
W warunkach fizjologicznych w organizmie znajduje się stosunkowo niewielka liczba limfocytów B naiwnych i pamięci. Jako że organizm musi mieć możliwość odpowiedzi na znaczną liczbę potencjalnych patogenów, utrzymuje on pewną pulę limfocytów B o szerokim zakresie specyficzności. W rezultacie, mimo że prawie zawsze obecna jest przynajmniej jedna komórka (naiwna czy pamięci), która ma możliwość odpowiedzi na dany epitop, niewiele jest dokładnych kopii. Gdy jednak pojedynczy limfocyt B napotyka antygen, z którym się wiąże, jest w stanie bardzo szybko proliferować. Grupa komórek o identycznym powinowactwie względem danego epitopu nosi nazwę klonu i wywodzi się od pojedynczej komórki „matki”. Wszystkie potomne limfocyty B mają taką samą specyficzność względem epitopu jak komórka „matka” i produkują przeciwciała o identycznych paratopach. Takie przeciwciała noszą nazwę monoklonalnych, gdyż pochodzą od klonów tej samej komórki „matki”. Odpowiedź poliklonalna to taka, w której klony wielu limfocytów B reagują na ten sam antygen.
Pojedynczy antygen zawiera wiele zachodzących na siebie epitopów[edytuj | edytuj kod]

Pojedynczy antygen można przedstawić jako sekwencję wielu zachodzących na siebie epitopów. Wiele unikalnych klonów limfocytów B może posiadać umiejętność wiązania z poszczególnymi epitopami. Niesie to z sobą jeszcze większe zróżnicowanie ogólnej odpowiedzi. Każdy z tych limfocytów B może ulec aktywacji i produkować ogromne kolonie klonów komórek plazmatycznych, a każda z nich może wydzielić do tysiąca cząsteczek przeciwciał przeciwko jednemu epitopowi w ciągu sekundy.
Wiele różnych klonów rozpoznaje jeden epitop[edytuj | edytuj kod]
Oprócz tego, że różne klony limfocytów B rozpoznają różne epitopy będące częścią jednego antygenu, limfocyty B należące do różnych klonów mogą również rozpoznawać ten sam epitop. O epitopie rozpoznawanym przez wiele różnych limfocytów B mówi się, że jest wysoce immunogenny. W takim przypadku poszczególne pary epitop-paratop mogą różnić się powinowactwem wiązania – jedne klony limfocytów B mogą produkować przeciwciała, które będą wiązać epitop z większą siłą, a inne – z mniejszą.
Selekcja klonalna[edytuj | edytuj kod]
W przypadku klonów, które wiążą się z konkretnym epitopem z większą siłą istnieje większe prawdopodobieństwo, że ulegną one selekcji do dalszej proliferacji w ośrodkach rozmnażania w grudkach chłonnych umiejscowionych w różnych narządach układu limfatycznego, jak np. węzły chłonne. Przypomina to nieco selekcję naturalną: selekcja klonów opiera się na przystosowaniu do atakowania epitopów (sile wiązania) u napotkanego patogenu. Fakt, że limfocyty B muszą konkurować ze sobą nawzajem o sygnały promujące ich przetrwanie w ośrodkach rozmnażania, dodatkowo wzmacnia analogię.
Zróżnicowanie klonów limfocytów B[edytuj | edytuj kod]
Istnieje wiele różnorodnych patogenów, a wiele spośród nich ulega ciągłym mutacjom. Zaskakującym może więc wydać się fakt, że większość populacji ludzkiej nie jest zakażona. Świadczy to o tym, że utrzymanie zdrowia wymaga od organizmu umiejętności rozpoznania wszystkich patogenów (antygenów, które patogeny prezentują lub produkują), które mogą występować. Uzyskuje się to przez ciągłe utrzymywanie olbrzymiej (około 109) puli klonów limfocytów B, z których każdy jest reaktywny względem konkretnego epitopu poprzez rozpoznanie go i produkcję przeciwciał skierowanych przeciwko niemu. Jednak przez większość czasu istnieje niewiele klonów, które są w rzeczywistości w stanie rozpoznać odpowiadający sobie epitop. Tak więc wszystkie klony limfocytów B są w stanie rozpoznać w sumie około 107 różnych epitopów. Ponadto w ciągu życia organizm zazwyczaj potrzebuje wytwarzać przeciwciała przeciwko niewielkiej liczbie antygenów w porównaniu z liczbą tych, które jest w stanie rozpoznać i na obecność których może zareagować.
Znaczenie zjawiska[edytuj | edytuj kod]
Zwiększone prawdopodobieństwo rozpoznania antygenu[edytuj | edytuj kod]
Jeśli antygen można rozpoznać po więcej niż jednym elemencie struktury, występuje mniejsze prawdopodobieństwo, że zostanie „przegapiony” przez układ immunologiczny. Mutacja organizmu patogennego może skutkować modyfikacją struktury antygenu, a przez to i epitopu. Jeśli układ immunologiczny „pamięta”, jak wyglądają inne epitopy, wciąż będzie w stanie rozpoznać antygen, a zatem i cały organizm, i skierować przeciw niemu odpowiedź immunologiczną. W ten sposób odpowiedź poliklonalna zwiększa zakres patogenów, które mogą być rozpoznawane.
Ograniczenia układu immunologicznego w walce z szybko mutującymi wirusami[edytuj | edytuj kod]
Wiele wirusów ulega częstym mutacjom, które powodują zmiany w składzie aminokwasów istotnych białek. Epitopy na białku również mogą ulec zmianom wskutek tego procesu. Zmieniony epitop zwiąże się z mniejszą siłą z przeciwciałami swoistymi dla niezmienionego epitopu, który pobudziłby układ immunologiczny. Jest to dość niefortunne, gdyż w wyniku hipermutacji somatycznych powstają klony, które są w stanie wyprodukować rozpuszczalne przeciwciała wiążące się ze zmienionym epitopem z wystarczającą awidnością do jego neutralizacji. Jednak klony te składają się z komórek naiwnych, których proliferację blokują przeciwciała o słabej sile wiązania wyprodukowane przez uprzednio zastymulowany klon. Zjawisko to nosi w literaturze anglojęzycznej nazwę orignal antigenic sin(„antygenowy grzech pierworodny”). Zjawisko to odgrywa rolę głównie w przypadku odpowiedzi immunologicznej na wirusy grypy, dengi czy HIV. Ograniczenie nie wynika jednak z samej poliklonalności, a raczej jest skierowane przeciwko niemu przez odpowiedź immunologiczną, która faworyzuje doświadczone komórki pamięci, a nie „niedoświadczone” komórki naiwne.
Zwiększone prawdopodobieństwo reakcji autoimmunologicznych[edytuj | edytuj kod]
Reakcje autoimmunologiczne polegają na tym, że układ immunologiczny błędnie rozpoznaje pewne własne białka jako obce (antygen własny) i kieruje przeciw nim odpowiedź immunologiczną. Jako że białka te są naturalnymi elementami organizmu, skierowany przeciwko nim atak przybiera na sile z upływem czasu (podobnie jak w przypadku odpowiedzi wtórnej). Ponadto, wiele organizmów stosuje mimikrę antygenową, która opiera się na prezentowaniu na powierzchni antygenów przypominających białka gospodarza. Niesie to z sobą dwa rodzaje potencjalnych konsekwencji: albo organizm, uznany za własny antygen, nie zostanie zaatakowany, albo wyprodukowane przeciwko niemu przeciwciała będą wiązały się również z własnymi białkami naśladowanymi przez białka patogenu. Przeciwciała zaatakują własne antygeny i tkanki, w których się znajdują poprzez aktywację różnych mechanizmów, takich jak aktywacja układu dopełniacza czy cytotoksyczność komórkowa zależna od przeciwciał (ADCC – antibody-dependent cell-mediated cytotoxicity). Dlatego też im większy zakres specyficzności przeciwciał, tym większe prawdopodobieństwo, że któreś z nich będzie reagowało przeciwko własnym antygenom (cząsteczkom naturalnie występującym w organizmie).
Trudności przy produkcji przeciwciał monoklonalnych[edytuj | edytuj kod]
Przeciwciała monoklonalne są cząsteczkami immunoglobulin o identycznej strukturze i specyficzności względem antygenu (wszystkie mają takie samo powinowactwo względem epitopu), w przeciwieństwie do przeciwciał poliklonalnych, które cechuje różne powinowactwo względem jednego epitopu. Przeciwciała monoklonalne nie są zazwyczaj produkowane w toku naturalnej odpowiedzi immunologicznej, a tylko w stanach chorobowych, jak np. szpiczak mnogi czy w wyniku procedur laboratoryjnych. Ze względu na swoją specyficzność, przeciwciała monoklonalne są wykorzystywane do wykrycia obecności substancji lub ustalenia jej ilości (substancja odgrywa rolę antygenu dla przeciwciał monoklonalnych), a także do oznaczania pojedynczych komórek (np. komórek nowotworowych). Przeciwciała monoklonalne są stosowane w wielu procedurach diagnostycznych (patrz: western blot i immunofluorescencja) i terapiach – głównie nowotworów i chorób z komponentem autoimmunologicznym. Skoro jednak praktycznie wszystkie naturalne odpowiedzi są poliklonalne, produkcja niezwykle użytecznych przeciwciał monoklonalnych jest bardziej skomplikowana.
Historia[edytuj | edytuj kod]
Pierwszy przypadek wykrycia we krwi neutralizującej substancji zwalczającej infekcje odnotowano, gdy Emil von Behring i Kitasato Shibasaburō wyprodukowali skuteczną surowicę przeciw błonicy. Dokonali transferu surowicy wyprodukowanej przez zwierzęta immunizowane przeciwko błonicy do organizmów chorych zwierząt. Okazało się, że transfer surowicy prowadzi do wyleczenia zainfekowanych zwierząt. Behring otrzymał za to odkrycie Nagrodę Nobla w 1901 roku.
Na tym etapie nie było jednak wiadomo, jaki składnik krwi odpowiada za ochronę. W następnych dekadach udowodniono, że surowica ochronna jest w stanie neutralizować i strącać toksyny oraz zlepiać komórki bakteryjne. Poszczególne funkcje przypisywano odrębnym substancjom zawartym w surowicy, które nazwano odpowiednio antytoksyną, precypityną i aglutyniną. Elvin A. Kabat udowodnił w 1939 roku, że wszystkie te substancje są w rzeczywistości jedną (gamma globuliną). W poprzednim roku Kabat zaprezentował niesamowitą różnorodność przeciwciał za pomocą ultrawirowania końskiej surowicy.
Do tego czasu odporność komórkowa i humoralna były traktowane jako rywalizujące teorie tłumaczące skuteczną odpowiedź immunologiczną, lecz rozwój pierwszej z nich pozostawał w tyle z powodu braku odpowiednio zaawansowanych technologii. Badania nad odpornością komórkową nabrały impetu, kiedy w 1942 roku Merrill Chase dokonał udanego transferu odporności przeciwko gruźlicy pomiędzy świniami poprzez transfer białych krwinek.
Astrid Fagraeus wykazała w swojej pracy doktorskiej z 1948 roku, że komórki plazmatyczne biorą udział w produkcji przeciwciał. Rolę limfocytów w odpowiedzi zarówno komórowej, jak i humoralnej udowodnił James Gowans w 1959 roku.
Próbując uzasadnić szeroki zakres antygenów rozpoznawanych przez układ immunologiczny, Paul Ehrlich postawił w 1900 roku hipotezę głoszącą, że istniejące wcześniej „receptory łańcuchów bocznych” wiążą się z określonym patogenem i że taka interakcja indukuje powielenie komórki prezentującej receptor i produkcję kopii receptora. Teorii tej, noszącej nazwę teorii selektywnej nie udowodniono przez kolejne pięć dekad i była podważana przez szereg teorii instrukcyjnych, opartych na założeniu, że przeciwciało przyjmuje swoją efektywną formę poprzez zwijanie się wokół antygenu. Pod koniec lat 50. XX wieku prace trzech uczonych – Jerne’a, Talmage’a i Burneta (który wprowadził znaczne modyfikacje do teorii) – dały podstawę teorii selekcji klonalnej, która udowodniła wszystkie elementy hipotezy Ehrlicha poza tym, że swoiste receptory neutralizujące czynnik patogenny były rozpuszczalne, a nie związane z błoną.
Teorię selekcji klonalnej potwierdzono, gdy Sir Gustav Nossal udowodnił, że jeden klon limfocytu B zawsze produkuje tylko jeden rodzaj przeciwciała.
Następnie Rolf Zinkernagel i Peter C. Doherty udowodnili w 1974 roku rolę cząsteczek MHC w prezentacji antygenu.