Sekwencjonowanie DNA: Różnice pomiędzy wersjami
| [wersja nieprzejrzana] | [wersja przejrzana] |
m MalarzBOT: dodanie daty do szablonu fakt na podstawie edycji http://pl.wikipedia.org/w/index.php?title=Sekwencjonowanie%20DNA&diff=prev&oldid=44026042 |
drobne redakcyjne, drobne techniczne, drobne merytoryczne, WP:SK |
||
| Linia 17: | Linia 17: | ||
Obecnie odczyt sekwencji w metodzie Sangera został zautomatyzowany dzięki wykorzystaniu znakowanych [[fluorescencja|fluorescencyjnie]] trifosforanów dideoksynukleotydów i pozwala na odczyt 300-1000 par zasad z jednej [[kapilara|kapilary]] lub linii na [[żel]]u{{fakt|data=2010-03}}. |
Obecnie odczyt sekwencji w metodzie Sangera został zautomatyzowany dzięki wykorzystaniu znakowanych [[fluorescencja|fluorescencyjnie]] trifosforanów dideoksynukleotydów i pozwala na odczyt 300-1000 par zasad z jednej [[kapilara|kapilary]] lub linii na [[żel]]u{{fakt|data=2010-03}}. |
||
Nowoczesne |
Nowoczesne (2013) aparaty do sekwencjonowania DNA są w stanie pracować z szybkością rzędu milionów [[para zasad|par zasad]] dziennie<ref>{{Cytuj książkę|nazwisko = Soh J., Gordon P., Sensen C.|imię = |tytuł = Genome Annotation|rok = 2013|wydawca = Chapman & Hall/CRC|miejsce = |strony = 1|isbn = 978-1-4398-41174|url={{Google Books|PKfMBQAAQBAJ|Genome Annotation|strony=1|link=tak}}}}</ref>. [[tranzystor polowy DNA|Tranzystory polowe DNA]] umożliwiają użycie natywnego DNA w hybrydyzacji do [[Mikromacierz DNA|mikromacierzy]] i odczyt w czasie rzeczywistym. |
||
Nagroda [[X Prize Foundation|Archon Genomics X PRIZE]] w wysokości 10 mln dolarów czeka na ośrodek, który będzie w stanie zsekwencjonować 100 [[genom]]ów ludzkich w ciągu 10 dni<ref>[http://genomics.xprize.org/newsevents/press_releases_2006-10-04_Archon_X_PRIZE_for_Genomics.html ogłoszenie o konkursie X Prize Foundation] {{lang|en}}</ref>. Pierwsze sekwencjonowanie genomu człowieka zajęło wiele lat (zob. [[Projekt poznania ludzkiego genomu]]). |
Nagroda [[X Prize Foundation|Archon Genomics X PRIZE]] w wysokości 10 mln dolarów czeka na ośrodek, który będzie w stanie zsekwencjonować 100 [[genom]]ów ludzkich w ciągu 10 dni<ref>[http://genomics.xprize.org/newsevents/press_releases_2006-10-04_Archon_X_PRIZE_for_Genomics.html ogłoszenie o konkursie X Prize Foundation] {{lang|en}}</ref>. Pierwsze sekwencjonowanie genomu człowieka zajęło wiele lat (zob. [[Projekt poznania ludzkiego genomu]]). |
||
| Linia 26: | Linia 26: | ||
* [[pirosekwencjonowanie]]; jego wersja "sekwencjonowanie 454" pozwala odczytać 300 MBp na dzień w jednej maszynie. Metoda ta jest szczególnie przydatna do sekwencjonowania [[aDNA]]. |
* [[pirosekwencjonowanie]]; jego wersja "sekwencjonowanie 454" pozwala odczytać 300 MBp na dzień w jednej maszynie. Metoda ta jest szczególnie przydatna do sekwencjonowania [[aDNA]]. |
||
* bezpośredniego odczytu{{fakt|data=2010-03}}: |
* bezpośredniego odczytu{{fakt|data=2010-03}}: |
||
** nanosekwencjonowanie. Przesuwająca się cząsteczka DNA poprzez centrum aktywne modyfikowanych polimeraz jest odczytywana bezpośrednio. Szybkość takiego odczytu może dochodzić od 300 Bp/s dla pojedynczego nanometrowego czujnika<ref>{{Cytuj stronę | url = http://visigenbio.com/technology_overview.html| tytuł = Technology Overview | data dostępu = 2015-03-24 | autor = | nazwisko = | imię = | autor link = | data = | rok = | miesiąc = | praca = | opublikowany = | oznaczenie = | strony = | język = en| id = | cytat = | archiwum = https://web.archive.org/web/20080907134124/http://visigenbio.com/technology_overview.html| zarchiwizowano = 2008-09-07 |
** nanosekwencjonowanie. Przesuwająca się cząsteczka DNA poprzez centrum aktywne modyfikowanych polimeraz jest odczytywana bezpośrednio. Szybkość takiego odczytu może dochodzić od 300 Bp/s dla pojedynczego nanometrowego czujnika<ref>{{Cytuj stronę | url = http://visigenbio.com/technology_overview.html| tytuł = Technology Overview | data dostępu = 2015-03-24 | autor = | nazwisko = | imię = | autor link = | data = | rok = | miesiąc = | praca = | opublikowany = | oznaczenie = | strony = | język = en| id = | cytat = | archiwum = https://web.archive.org/web/20080907134124/http://visigenbio.com/technology_overview.html| zarchiwizowano = 2008-09-07}}</ref>. |
||
** mikroskopowe |
** mikroskopowe |
||
Wersja z 12:09, 8 lis 2015
Sekwencjonowanie DNA – technika odczytywania sekwencji, czyli kolejności par nukleotydowych w cząsteczce DNA.
Sekwencjonowanie dokonuje się obecnie głównie za pomocą zautomatyzowanych sekwencjonatorów. Manualne sekwencjonowanie stosuje się przy opracowywaniu nowatorskich metod, w niektórych laboratoriach dla krótkich fragmentów lub podczas ćwiczeń[potrzebny przypis].
- Przykład sekwencji DNA (początek operonu laktozowego E. coli z GenBank):
GACACCATCGAATGGCGCAAAACCTTTCGCGGTATGGCATGATAGCGCCCGGAAGAGAGTCAATTCAGGG
- gdzie: A – deoksyadenozyna; C – deoksycytydyna; G – deoksyguanozyna; T – tymidyna
Metody historyczne

A – przykładowa sekwencja DNA
B – przyłączenie startowego oligonukleotydu do nici matrycowej i kierunek syntezy DNA
C – produkty syntezy DNA, zakończone fluorescencyjnie znakowanymi dideoksynukleotydami (kolorowe litery)
D – elektroforegram rozdziału otrzymanej mieszaniny fragmentów w elektroforezie kapilarnej wraz z zidentyfikowaną sekwencją (powyżej)
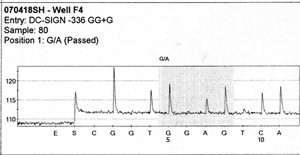
Historyczną już i wypieraną metodą jest opracowana w 1977 r. metoda Sangera, oparta o syntezę DNA przez polimerazę DNA in vitro[1]. Do reakcji dodaje się niewielką ilość trifosforanów dideoksynukleotydów (ddNTP), które są wbudowywane w DNA, ale ich dołączenie uniemożliwia dalsze wydłużanie nici. W ten sposób otrzymuje się fragmenty DNA o różnej długości zakończone specyficznym nukleotydem. Produkty reakcji rozdziela się elektroforetycznie, co powoduję ich segregację pod względem wielkości.
Autorem alternatywnej metody sekwencjonowania DNA, z wykorzystaniem specyficznej, chemicznej degradacji DNA, byli Walter Gilbert i Allan Maxam (metoda Maxama-Gilberta)[2]. Gilbert wraz z Frederickiem Sangerem otrzymali za to osiągnięcie nagrodę Nobla w dziedzinie chemii. Metoda Maxama-Gilberta obecnie jest rzadko stosowana.
Metody współczesne
Obecnie odczyt sekwencji w metodzie Sangera został zautomatyzowany dzięki wykorzystaniu znakowanych fluorescencyjnie trifosforanów dideoksynukleotydów i pozwala na odczyt 300-1000 par zasad z jednej kapilary lub linii na żelu[potrzebny przypis].
Nowoczesne (2013) aparaty do sekwencjonowania DNA są w stanie pracować z szybkością rzędu milionów par zasad dziennie[3]. Tranzystory polowe DNA umożliwiają użycie natywnego DNA w hybrydyzacji do mikromacierzy i odczyt w czasie rzeczywistym.
Nagroda Archon Genomics X PRIZE w wysokości 10 mln dolarów czeka na ośrodek, który będzie w stanie zsekwencjonować 100 genomów ludzkich w ciągu 10 dni[4]. Pierwsze sekwencjonowanie genomu człowieka zajęło wiele lat (zob. Projekt poznania ludzkiego genomu).
Nowoczesne metody sekwencjonowania DNA są na tyle tanie, iż setki tysięcy osób zapłaciły za zbadanie swojego DNA i wzięły udział w Projekcie Genograficznym. Ta względna taniość umożliwiła również rozwój m.in. genetyki genealogicznej oraz wielu rodzajów badań testujących obecność mutacji.
Metody rozwojowe
- pirosekwencjonowanie; jego wersja "sekwencjonowanie 454" pozwala odczytać 300 MBp na dzień w jednej maszynie. Metoda ta jest szczególnie przydatna do sekwencjonowania aDNA.
- bezpośredniego odczytu[potrzebny przypis]:
- nanosekwencjonowanie. Przesuwająca się cząsteczka DNA poprzez centrum aktywne modyfikowanych polimeraz jest odczytywana bezpośrednio. Szybkość takiego odczytu może dochodzić od 300 Bp/s dla pojedynczego nanometrowego czujnika[5].
- mikroskopowe
Historia rozwoju metod sekwencjonowania DNA
- 1953 – opracowanie modelu podwójnej helisy DNA przez Jamesa Watsona i Francisa Cricka
- 1972 – opracowanie sposobów izolacji materiału do dalszych badań. Rozwój technologii rekombinacji umożliwiający izolację dowolnych fragmentów DNA i ich replikację.
- 1977 – Allan Maxam i Walter Gilbert ogłaszają publikację pt. Sekwencjonowanie DNA przez chemiczną degradację. W tym samym czasie Sanger opublikował też metodę sekwencjonowania DNA przez syntezę katalizowaną enzymatycznie.
- 1980 – Fred Sanger i Walter Gilbert otrzymali nagrodę Nobla
- 1982 – utworzono Genbank – publicznie dostępną bazę danych sekwencji DNA
- Andre Marion i Samuel Eletr utworzyli firmę Applied Biosystems, która w tym okresie zdominowała automatyczne sekwencjonowanie DNA
- 1982 – Akiyoshi Wada zbudował roboty sekwencyjne dla firmy Hitachi.
- 1984 – badacze z MRC odczytali kompletną sekwencję wirusa Epstein-Barr, 170 kb.
- 1997 – zsekwencjonowano 5Mb genom bakterii Escherichia coli.
- 2001, 15 lutego – Konsorcjum HUGO opublikowało sekwencję genomu ludzkiego w Nature.
- 2001, 16 lutego – firma Celera Genomics opublikowała sekwencję genomu ludzkiego w Science.
Zobacz też
- ↑ Sanger, F, Nicklen, S, Coulson, AR. DNA sequencing with chain-terminating inhibitors. „Proc Natl Acad Sci U S A”. 74. 12, s. 5463–5467, 1977. PMID 431765.
- ↑ A M Maxam and W Gilbert, A new method for sequencing DNA, Proc Natl Acad Sci U S A. 1977 February; 74(2): 560–564.
- ↑ Soh J., Gordon P., Sensen C.: Genome Annotation. Chapman & Hall/CRC, 2013, s. 1. ISBN 978-1-4398-41174.
- ↑ ogłoszenie o konkursie X Prize Foundation (ang.)
- ↑ Technology Overview. [dostęp 2015-03-24]. [zarchiwizowane z tego adresu (2008-09-07)]. (ang.).
