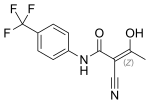Teryflunomid
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny |
C12H9F3N2O2 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
270,21 g/mol | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | |||||||||||||||||||
| PubChem | |||||||||||||||||||
| DrugBank | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||
| ATC | |||||||||||||||||||
| |||||||||||||||||||
Teryflunomid – wielofunkcyjny organiczny związek chemiczny, aktywny metabolit leflunomidu[3]. Jest środkiem immunomodulującym o właściwościach przeciwzapalnych. Stosowany w leczeniu stwardnienia rozsianego.
Wskazania[edytuj | edytuj kod]
Jest wskazany w leczeniu dorosłych pacjentów ze stwardnieniem rozsianym o przebiegu rzutowo-ustępującym[4] i jest kwalifikowany jako lek pierwszego wyboru w leczeniu tej choroby[5].
Skuteczność[edytuj | edytuj kod]
Stosowany raz na dobę w dawce 14 mg dobę powoduje zmniejszenie częstości rzutów o ok. 30% i obniżenie ryzyka progresji niewydolności ruchowej o 30% w skali roku[6]. W badaniach MRI wykazano, że leczenie teryflunomidem, w porównaniu z podawaniem placebo, powoduje zmniejszenie całkowitej objętości nowych zmian o 69% oraz zmniejszenie o 80% liczby zmian wykazujących wzmocnienie kontrastowe[5].
Mechanizm działania[edytuj | edytuj kod]
Teryflunomid jest środkiem immunomodulującym, który w sposób wybiórczy i odwracalny hamuje aktywność enzymu mitochondrialnego – dehydrogenazy dihydroorotanowej, wymaganego do syntezy pirymidyny de novo. W rezultacie teryflunomid zmniejsza proliferację podzielonych komórek, które do ekspansji potrzebują syntezy pirymidyny de novo[7]. Dokładny mechanizm terapeutycznego działania teryflunomidu w leczeniu stwardnienia rozsianego nie jest do końca wyjaśniony, ale może on obejmować redukcję liczby limfocytów. Mediana czasu do osiągnięcia maksymalnego stężenia w osoczu wynosi 1–4 h po wielokrotnym doustnym podaniu teryflunomidu, przy wysokiej biodostępności (około 100%). Osiągnięcie stężenia stanu stacjonarnego jest procesem powolnym (tj. osiągnięcie 95% stężenia w stanie stacjonarnym następuje po około 100 dniach, a szacowany współczynnik kumulacji AUC jest ok. 34-krotny). Teryflunomid w znacznym stopniu wiąże się z białkami osocza (>99%), prawdopodobnie z albuminą, i podlega dystrybucji głównie w osoczu. Metabolizowany jest w stopniu umiarkowanym i jest jedynym składnikiem wykrywanym w osoczu. Głównym szlakiem metabolizmu teryflunomidu jest hydroliza, a utlenianie stanowi szlak drugorzędny. Wydzielany jest do przewodu pokarmowego głównie z żółcią jako produkt leczniczy w postaci niezmienionej i najprawdopodobniej przez sekrecję bezpośrednią[8].
W przypadku teryflunomidu można w określonych w charakterystyce produktu przypadkach przeprowadzić procedurę przyspieszonej eliminacji. Eliminacja teryflunomidu z krążenia może być przyspieszona po podaniu cholestyraminy lub węgla aktywowanego, przypuszczalnie wskutek przerwania procesów wchłaniania zwrotnego na poziomie jelit[8].
Przypisy[edytuj | edytuj kod]
- ↑ a b Teriflunomide, [w:] DrugBank, University of Alberta, DB08880 (ang.).
- ↑ Teriflunomide (nr SML0936) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2017-05-26]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ D. Magne i inni, The active metabolite of leflunomide, A77 1726, increases proliferation of human synovial fibroblasts in presence of IL-1β and TNF-α, „Inflammation Research”, 55 (11), 2006, s. 469–475, DOI: 10.1007/s00011-006-5196-x, PMID: 17122964.
- ↑ A. Doshi, J. Chataway, Multiple sclerosis, a treatable disease, „Clinical Medicine”, 16 (Suppl 6), 2016, s53–s59, DOI: 10.7861/clinmedicine.16-6-s53, PMID: 27956442.
- ↑ a b Jacek Losy i inni, Leczenie stwardnienia rozsianego. Zalecenia Polskiego Towarzystwa Neurologicznego, „Polski Przegląd Neurologiczny”, 12 (2), 2016, s. 80–95.
- ↑ Aubagio [online], Centrum Informacji o Leku [dostęp 2017-02-07] [zarchiwizowane z adresu 2017-02-08].
- ↑ Jarosław Filipek, Nowe rejestracje UE – sierpień 2013 [online], Aptekarz Polski, 26 września 2013 [dostęp 2017-02-07].
- ↑ a b Charakterystyka produktu leczniczego – Aubagio [online] [dostęp 2017-02-07].