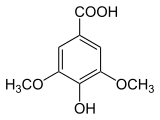
Kwas syryngowy
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C9H10O5 | ||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
198,17 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
jasnobrązowy proszek[2] | ||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||
Kwas syryngowy – organiczny związek chemiczny, pochodna kwasu galusowego. Ma działanie antybakteryjne i przeciwutleniające[5][6]. Występuje w m.in. w konyzie kanadyjskiej (Conyza canadensis)[7], kasztanie japońskim (Castanea crenata), rdeście wężowniku (Polygonum bistorta)[5], Aristolochia fangchi, Knoxia valerianoides[8], babce lancetowatej (Plantago lanceolata)[9] oraz miodzie z manuki (Leptospermum scoparium)[10].
Otrzymywany syntetycznie przez selektywną, częściową demetylację kwasu 3,4,5-trimetoksybenzoesowego za pomocą dymiącego kwasu siarkowego[11] lub jodku magnezu[12]. Ogrzewany powyżej 250 °C ulega dekarboksylacji do pirogalolu[13].
Stosowany jest w syntezie chemicznej, m.in. w polimeryzacji utleniającej katalizowanej peroksydazą chrzanową w obecności nadtlenku wodoru jako czynnika utleniającego, prowadzącej do otrzymania poli(fenylenoeteru) (PPE)[14].
Kwas syryngowy powstaje naturalnie w wyniku rozkładu 3-O-glukozydu malwidyny – oeniny – występującego w młodym winie czerwonym i odpowiedzialnego za jego jasnoczerwoną barwę. Dzięki temu jest on markerem molekularnym, którego wykrycie w badanych próbkach w czasie badań archeologicznych świadczy o pozostałościach po czerwonym winie[15][16][17].
Przypisy[edytuj | edytuj kod]
- ↑ a b Syringic acid, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2011-07-03] (ang.).
- ↑ a b c d Kwas syryngowy (nr S6881) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2011-07-03]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Gunhild Aulin-Erdtman, Laila Hegbom. „Svensk Papperstidning”. 60, s. 671–676, 1957. Cyt. za bazą danych Reaxys, Reaxys Registry Number: 2115262.
- ↑ Kwas syryngowy (nr S6881) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2011-07-03]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b Chung Ki Sung, Takeatsu Kimura, Paul P.H. But, Ji-Xian Guo: International Collation of Traditional and Folk Medicine. Northeast Asia. T. 3. Cz. 3. World Scientific, 1998, s. 23, 26. ISBN 978-981-02-3639-7. [dostęp 2011-07-03]. (ang.).
- ↑ Nathaniel Altman: The Honey Prescription: The Amazing Power of Honey As Medicine. Healing Arts Press, 2010, s. 80. ISBN 978-1-59477-346-4. [dostęp 2011-07-03]. (ang.).
- ↑ Lyle E. Craker, James E. Simon: Herbs, Spices, and Medicinal Plants. Recent Advances in Botany, Horticulture, and Pharmacology. T. 2. Routledge, 1991, s. 38. ISBN 978-1-56022-018-3. [dostęp 2011-07-03]. (ang.).
- ↑ Takeatsu Kimura, Ji-Xian Guo, Chung Ki Sung: International Collation of Traditional and Folk Medicine. Northeast Asia. T. 2. Cz. 2. World Scientific, 1996, s. 23, 26. ISBN 978-981-02-3130-9. [dostęp 2011-07-03]. (ang.).
- ↑ Gabriëlla Harriët Schmelzer, Ameenah Gurib-Fakim: Plant Resources of Tropical Africa. T. 11: Medicinal Plants. PROTA, 2008, s. 460. ISBN 978-90-5782-204-9. [dostęp 2011-07-03]. (ang.).
- ↑ Rekha S. Singhal, Pushpa R. Kulkarni, Dinanath V. Rege: Handbook of Indices of Food Quality and Authenticity. Woodhead Publishing, 1997, s. 376. ISBN 978-1-85573-299-5. [dostęp 2011-07-03]. (ang.).
- ↑ V.K. Ahluwalia, Pooja Bhagat, Renu Aggarwal, Ramesh Chandra: Intermediates For Organic Synthesis. I.K. International, 2005, s. 90–91. ISBN 978-81-88237-33-3. [dostęp 2011-07-03]. (ang.).
- ↑ K. Bao, A. Fan, Y. Dai, L. Zhang i inni. Selective demethylation and debenzylation of aryl ethers by magnesium iodide under solvent-free conditions and its application to the total synthesis of natural products. „Org Biomol Chem”. 7 (24), s. 5084–5090, 2009. DOI: 10.1039/b916969e. PMID: 20024102.
- ↑ Georg Hahn, Ernst Kappes, Ludewig Hermann. Über Yohimbehe-Alkaloide, VIII. Mitteil.: Die Dehydrierung des Yohimbins mit Bleitetraacetat und die Konstitutionsformel des Yohimbins. „Chemische Berichte”. 67 (4), s. 686–696, 1934. DOI: 10.1002/cber.19340670429.
- ↑ Shirō Kobayashi, Helmut Ritter, David Kaplan: Advances in Polymer Science. T. 194: Enzyme-Catalyzed Synthesis of Polymers. Birkhäuser, 2006, s. 36. ISBN 978-3-540-29212-8. [dostęp 2011-07-03]. (ang.).
- ↑ Mark Pollard, Catherine Batt, Ben Stern, Suzanne M.M. Young: Analytical Chemistry in Archaeology. Cambridge University Press, 2007, s. 149. ISBN 978-0-521-65572-9. [dostęp 2011-07-03]. (ang.).
- ↑ Jean Claude Goyon, Christine Cardin: Proceedings of the Ninth International Congress of Egyptologists. T. 1. Peeters Publishers, 2007, s. 853, seria: Orientalia Lovaniensia Analecta. T. 150. ISBN 978-90-429-1717-0. [dostęp 2011-07-03]. (ang.).
- ↑ A. Mark Pollard, Carl Heron: Archaeological Chemistry. Wyd. 2. Royal Society of Chemistry, 2008, s. 258. ISBN 978-0-85404-262-3. [dostęp 2011-07-03]. (ang.).