سترونتيوم
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | سترونتيوم، 38، Sr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز قلوي ترابي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 2، 5، s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 87.62 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Kr]; 5s2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 8, 2 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 2.64 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 2.375 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1050 ك، 777 °س، 1431 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 1655 ك، 1382 °س، 2520 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 7.43 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 136.9 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 26.4 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 2, 1[1] (أكاسيده قاعدية قوية) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 0.95 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 549.5 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1064.2 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 4138 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 215 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 10±195 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 249 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الوجه | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 132 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 35.4 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 22.5 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 6.1 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 1.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-24-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر السترونتيوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
السترونتيوم [ملاحظة 1] عنصر كيميائي رمزه Sr وعدده الذرّي 38، وهو ينتمي إلى الفلزّات القلوية الترابية، التي تقع في المجموعة الثانية للجدول الدوري للعناصر. السترونتيوم فلز ذو لون أبيض فضي يميل إلى الصفرة، وهو عنصر نشيط كيميائياً، ويشكل طبقة أكسيد داكنة عند تعرض أسطحه للهواء. للسترونتيوم صفات فيزيائية وكيميائية شبيهة بميزات عناصر مجموعته من الفلزات القلوية الترابية القريبة منه، مثل الكالسيوم والباريوم. يوجد السترونتيوم طبيعياً في عدد من المعادن، مثل السليستيت والسترونتيانيت.
تنسب تسمية هذا العنصر ومعدن السترونتيانيت إلى قرية سترونتيان الأسكتلندية، والتي اكتشف فيها أداير كروفورد ووليام كرويكشانك المعدن أولاً في سنة 1790. وقد عرف أن المعدن حاو على عنصر جديد في السنة التالية من لون اختبار اللهب الأحمر القرمزي المميز. أما عزل العنصر فقد قام به لأول مرة العالم همفري ديفي باستخدام تقنية التحليل الكهربائي المكتشفة حديثاً آنذاك. كان السترونتيوم مستخدماً بكثرة أثناء القرن التاسع عشر في إنتاج السكر من الشمندر السكري؛ كما استخدم بكثرة في أواسط القرن العشرين في تركيب شاشات أجهزة التلفاز العاملة بصمام الأشعة المهبطية. ولكن بعد تطور أجهزة التلفاز والاستغناء عن الصمامات المفرغة، انخفض الاستهلاك العالمي من السترونتيوم بشكل كبير.
يتكون معظم السترونتيوم الطبيعي من النظير سترونتيوم-88 المستقر، ولكن النظير سترونتيوم-90 هو نظير مشع، وهو أحد المكونات الخطيرة للهطول النووي، إذ يمتص السترونتيوم من الجسم بشكل مماثل لامتصاص الكالسيوم. بالمقابل، لا يشكل السترونتيوم المستقر الطبيعي أي خطر على صحة الإنسان.
التاريخ وأصل التسمية[عدل]
بدأت قصة اكتشاف هذا العنصر في أواخر القرن الثامن عشر. ففي سنة 1790 كان كل من أداير كروفورد [ط 1] ووليام كرويكشانك [ط 2] مهتمأ بالبحث عن خامات الباريوم، وتمكنا من اكتشاف معدن جديد.[2] وصلت عينات هذا المعدن إلى العالم فريدرش غابرييل زولسر [ط 3] من أجل تحليله، وذلك بالتعاون مع يوهان فريدريش بلومنباخ [ط 4] وأطلقا عليه اسم «سترونتيانيت» [ط 5] نسبة إلى قرية سترونتيان [ط 6] الأسكتلندية والتي عثر فيها عليه.[3][4] تبين من التحليل أن المعدن متمايز عن معدن الوذريت [ط 7] وأنه حاو على عنصر جديد،[5] وذلك باستخدام عدة طرائق، منها اختبار اللهب.[6] وفي سنة 1793 تصدى توماس تشارلز هوب [ط 8]، بروفيسور الكيمياء في جامعة غلاسكو لمهمة دراسة معدن السترونتيانيت؛[7][8] وأكد صحة التخمينات السابقة لكروفورد أن المعدن قد يكون حاوياً على عنصر جديد، واقترح أن تطلق عليه تسمية سترونتيت [ط 9].[9][10][11] في السنوات اللاحقة، كانت مهمة عزل العنصر الجديد محط اهتمام عدد من العلماء بالإضافة إلى هوب، مثل مارتن كلابروت [ط 10] وريتشارد كيروان [ط 11] ويوهان توبياس لوفتز [ط 12]، الذين تمكنوا من تحضير مركبات جديدة لهذا العنصر من المعدن.[12]

لكن العنصر لم يعزل إلا سنة 1808 عندما تمكن الكيميائي همفري ديفي [ط 13] من ذلك باستخدام تقنية التحليل الكهربائي [ط 14] المكتشفة حديثاً آنذاك، ثم أعلن عن هذا الاكتشاف في محاضرة في الجمعية الملكية في لندن في ذات السنة؛[13] وأطلق على العنصر الجديد المكتشف اسم «سترونتيوم» [ط 15].[14][15][12][16]
كان أول تطبيق واسع النطاق للسترونتيوم في مجال إنتاج السكّر من الشمندر السكري. وكانت تلك عملية قائمة على استخدام محلول هيدروكسيد السترونتيوم في عمليات التبلور لاستحصال السكر من دبس السكر، وكانت لها براءة اختراع لصالح أوغوستين بيير دوبرانفو [ط 16] في سنة 1849.[17] توسع إنتاج السكر على نطاق أوسع باستخدم هذه الطريقة في العقد السابع من القرن التاسع عشر، ثم ساهمت صناعة السكّر الألمانية بنشر هذه العملية [ط 17] بشكل أوسع في أوائل القرن العشرين. قارب الاستهلاك العالمي من هيدروكسيد السترونتيوم في إنتاج السكر من الشمندر السكري قبل الحرب العالمية الأولى حوالي 100-150 ألف طن.[18] على الرغم من أن هيدروكسيد السترونتيوم كان خاضعاً لعملية إعادة تدوير في هذه العملية، إلا أن ذلك لم يكن يتم بشكل كامل، وكان هناك طلب موتفع لتعويض المفقود أثناء الإنتاج، الأمر الذي أدى إلى ازدياد الطلب على تعدين السترونتيانيت، وخاصة في محيط مدينة مونستر الألمانية. توقف هذا التعدين المكثف بعد اكتشاف معدن جديد للسترونتيوم، وهو معدن السليستيت، في مقاطعة غلوسترشير البريطانية.[19] كانت تلك المناجم قادرة على تموين أغلب الطلب العالمي على السترونتيوم ما بين 1884 و1941. وعلى الرغم من وجود توضعات كبيرة من معدن السليستيت في حوض غرناطة [ط 18]، إلا أن التعدين لم يبدأ إلا في خمسينيات القرن العشرين.[20]
لوحظ أثناء اختبارات الأسلحة النووية الجوية أن النظير سترونتيوم-90 هو واحد من نواتج الانشطار النووي، وبمردود مرتفع نسبياً. أدى ذلك الأمر إلى التوسع في الأبحاث والدراسات عن هذا الموضوع، خاصة مع احتمالية تخصيب هذا النظير في العظام نظراً لوجود شبه بين السترونتيوم والكالسيوم.[21][22]
الوفرة الطبيعية[عدل]

السترونتيوم وفير نسبياً في الطبيعة، وهو يأتي في المرتبة السادسة عشر من حيث وفرة العناصر الكيميائية على الأرض، ويقدر أن يكون تركيزه في القشرة الأرضية بين 360-370 جزء في المليون [ط 19].[23][24] وتلك وفرة طبيعية قريبة من وفرة الباريوم أو الكبريت أو الكربون. بسبب النشاط الكيميائي الجيد لهذا العنصر، فإنه لا يوجد في الطبيعة بشكله الحر، إنما مرتبطاً مع عناصر أخرى في المعادن. يوجد هذا العنصر بشكل رئيسي في معدني السليستيت (كبريتات السترونتيوم)، والسترونتيانيت (كربونات السترونتيوم)، بنسبة من السترونتيوم في التركيب تصل إلى 47.7% و59.4%، على الترتيب. عموماً يوجد هناك ما يقارب 200 معدن حاوٍ على السترونتيوم في تركيبه.[25]
للسترونتيوم خواص مشابهة للكالسيوم في المياه الجوفية، إذ تكون الأنواع الكيميائية المهيمنة في الأوساط المعتدلة إلى الحمضية على شكل أيون 2+Sr ثنائي التكافؤ. بوجود أيونات الكالسيوم، يشكل السترونتيوم عادة راسب مشتركاً [ط 20] مع معادن الكالسيوم مثل الكالسيت [ط 21] والأنهيدريت [ط 22] عند ارتفاع قيمة pH الوسط. في الأوساط المعتدلة إلى الحمضية، يرتبط السترونتيوم المنحل إلى الجسيمات في التربة عبر التبادل الكاتيوني [ط 23].[26] يبلغ متوسط محتوى السترونتيوم في مياه المحيطات مقدار 8 ميليغرام/الليتر؛[27][28] وهي أعلى بكثير من متوسط تراكيز الباريوم (13 ميكروغرام/الليتر).[29] بالمقابل، وبالمقارنة مع تراكيز الكالسيوم، فإن الكالسيوم أكثر وفرة في مياه المحيطات، فتراكيز السترونتيوم واقعة بين 82-90 ميكرومول/الليتر، وهي تراكيز أقل بشكل واضح من تركيز الكالسيوم (وسطياً بين 9.6-11.6 ميلي مول/الليتر).[30][31]
الاستخراج[عدل]
يعد معدنا السليستيت والسترونتيانيت الخامتان الرئيسيتان لاستخراج السترونتيوم من التوضعات الرسوبية في القشرة الأرضية. على الرغم من أن شكل الكربونات في معدن السترونتيانيت أسهل للاستخدام في التطبيقات المختلفة، إلا أنه لا توجد كميات كبيرة منه بشكل كاف للاستخراج، لذلك فإن السليستيت يتميز على السترونتيانيت بكونه أكثر وفرة بالحجم الكافي المجد اقتصادياً للتعدين والاستخراج.[32]
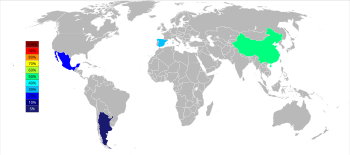
من الدول الرائدة في استخراج وإنتاج السترونتيوم كل من الصين وإسبانيا والمكسيك، كما تساهم دول أخرى في الإنتاج العالمي مثل الأرجنتين والمغرب وتركيا وإيران؛ كما تحوي الولايات المتحدة على احتياطي جيد من معادن السترونتيوم، إلا أن الاستخراج توقف منذ ستينيات القرن العشرين،[33] وبشكل مشابه، فإن بريطانيا كانت منتجة كبيرة للسترونتيوم في السابق، ولكن الإنتاج توقف منذ سنة 1992.[34] بلغ الإنتاج العالمي من السترونتيوم في سنة 2020 حوالي 350 ألف طن.[35]
| البلد | 2018 | 2019 | 2020 |
|---|---|---|---|
| (بالأطنان) | |||
| 700 | 700 | 700 | |
| 50.000 | 50.000 | 80.000 | |
| 37.000 | 37.000 | 90.000 | |
| 40.000 | 40.000 | 33.500 | |
| 90.000 | 90.000 | 150.000 | |
| 1.000 | 0 | 0 | |
| الإجمالي (التقريبي) | 220.000 | 220.000 | 350.000 |
الإنتاج[عدل]

المصدر الرئيسي لإنتاج السترونتيوم هو معدن السليستيت، وهو على شكل كبريتات، ويحول قسم كبير منه إلى كربونات. تجرى عملية التحويل وفق عمليتين؛ إما وفق عملية تصويل [ط 24] بالمعالجة المباشرة للسليستيت مع محلول كربونات الصوديوم، ولكن هذا الأسلوب غير شائع، أو بالتحميص [ط 25] مع الفحم عند درجات حرارة بين 1100–1200 °س لتشكيل كبريتيد السترونتيوم.[34] باتباع أسلوب التحميص يختزل ملح الكبريتات إلى ملح الكبريتيد بأسلوب كربوحراري [ط 26] وينتج غاز ثنائي أكسيد الكربون من العملية وفق التفاعل التالي:
يستحصل في النهاية على مادة داكنة مكونة بشكل أعظمي من ملح كبريتيد السترونتيوم، ويطلق عليها اسم الرماد الأسود [ط 27]، والتي يستخلص منها ملح الكبريتيد بالمعالجة مع الماء الساخن ثم الترشيح من اجل التهيئة للمرحلة اللاحقة. من أجل الحصول على ملح الكربونات من الكبريتيد، إما أن يضاف غاز ثنائي أكسيد الكربون إلى محلول الكبريتيد:[36]
أو أن تجرى المعالجة مع محلول كربونات الصوديوم، ويعتمد اختيار الأسلوب الأنجع على تركيز محلول كبريتيد السترونتيوم الأولي، وعلى نوع الشوائب في الخامة.[34]
يمكن الإنتاج بأسلوب آخر عن طريق اختزال أكسيد السترونتيوم بالألومنيوم عند درجات حرارة مرتفعة (تفاعل ألومنيوم حراري [ط 28])، يجرى هذا التفاعل تحت الفراغ ثم يقطّر السترونتيوم من المزيج.[34]
النظائر[عدل]
يوجد لعنصر السترونتيوم في الطبيعة أربعة نظائر، وهي سترونتيوم-84 84Sr، وسترونتيوم-86 86Sr، وسترونتيوم-87 87Sr، وسترونتيوم-88 88Sr.[29] وأكثر تلك النظائر وفرة طبيعية هو النظير سترونتيوم-88 88Sr، والذي يشكل 82.6% من عنصر السترونتيوم الطبيعي. إلا أنه يمكن أن يوجد تفاوت في نسبة تلك الوفرة نتيجة لتشكل النويدة ذات الأصل إشعاعي [ط 29] سترونتيوم-87 87Sr بشكل مستمر من الاضمحلال الإشعاعي طويل الأمد لنظير الروبيديوم 87Rb عبر اضمحلال بيتّا [ط 30] [37]. تعد هذه العلاقة بين هذين النظيرين الأساس العلمي للتأريخ بنظائر روبيديوم-سترونتيوم [ط 31].
هناك نظائر مصطنعة للسترونتيوم، وأغلبها غير مستقر، ويكون نمط الاضمحلال الرئيسي الأخف من 85Sr على هيئة التقاط إلكترون [ط 32] أو انبعاث البوزيترون [ط 33] إلى نظائر الروبيديوم؛ في حين أن نمط الاضمحلال الرئيسي للنظائر الأثقل من 88Sr على هيئة انبعاث إلكترون [ط 34] إلى نظائر الإتريوم. يعد النظيران سترونتيوم-89 89Sr وسترونتيوم-90 90Sr أكثر تلك النظائر المشعة محط اهتمام. للنظير سترونتيوم-89 عمر نصف [ط 35] مقداره 50.6 يوم، وله تطبيق في علاج سرطان العظام نظراً للتشابه بين السترونتيوم والكالسيوم.[38][39] من جهة أخرى، فإن للنظير سترونتيوم-90 عمر نصف مقداره 28.90 سنة، وهو أحد نواتج الانشطار النووي [ط 36] التي قد تكون ناتجة عن استخدام الأسلحة النووية أو نتيجة حوادث نووية وإشعاعية، بالتالي فهو أحد المكونات الخطيرة للهطول النووي. فوجوده في العظام قد يسبب سرطانات مختلفة، مثل سرطان العظام أو سرطان في الأنسجة القريبة، أو ابيضاض الدم [ط 37].[40]
الخواص الفيزيائية[عدل]

يوجد السترونتيوم في الظروف القياسية من الضغط ودرجة الحرارة على هيئة فلز ذي لون أبيض فضي وقد يميل أحياناً إلى الصفرة،[41] وله خواص فيزيائية شبيهة بالخواص الفيزيائية لمجموعة الفلزات القلوية الترابية، وتقع قيمتها وسطاً بين تلك التي لمجاوريه: الكالسيوم والباريوم،[42] فهو أطرى من الكالسيوم ولكنه أفسى من الباريوم. للسترونتيوم نقطة انصهار تبلغ 777 °س، ونقطة غليان 1377 °س، وهي قيم أقل من تلك التي للكالسيوم (842 °س و 1484 °س، على الترتيب). يصنف السترونتيوم ضمن الفلزات الخفيفة، وتبلغ كثافته مقدار 2.64 غ/سم3، وهي ذات قيمة وسطية بين الكالسيوم (1.54 غ/سم3) والباريوم (3.594 غ/سم3).[29]
يتبلور السترونتيوم وفق نظام بلوري مكعّب مركزي الوجه [ط 38] (نمط بنية النحاس)، ولثابت الشبكة البلورية [ط 39] a قيمة مقدارها 608.5 بيكومتر؛ بوجود أربع وحدات من الصيغة [ط 40] لكل وحدة خلية [ط 41]. يكتسب السترونتيوم شكلين إضافيين عند درجات حرارة مرتفعة، فعند درجات حرارة أعلى من 215 °س، تأخذ البنية شكل نظام بلوري سداسي [ط 42] (نمط بنية المغنيسيوم) بأبعاد شبكة بلورية مقادرها a = 432 وc = 706 بيكومتر؛ أما عند درجات حرارة أعلى من 605 °س، فإن البنية تعود مجدداً إلى النظام المكعب، ولكنه يكون مركزي الجسم [ط 43] (نمط بنية التنغستن).[43]
الخواص الكيميائية[عدل]

ينتمي السترونتيوم إلى الفلزات القلوية الترابية، وهو عنصر ثنائي التكافؤ، نشيط كيميائياً ويتفاعل مع أغلب اللافلزات مثل الهالوجينات و|الأكسجين والنتروجين والكبريت ليشكل المركبات الكيميائية الموافقة. يتفاعل السترونتيوم بعنف مع الماء بدرجة وسط بين الكالسيوم والباريوم، ويعطي التفاعل هيدروكسيد السترونتيوم مع انطلاق غاز الهيدروجين.
يحترق السترونتيوم في وسط من الهواء عند درجات حرارة مرتفعة منتجاً أكسيد السترونتيوم ونتريد السترونتيوم؛ ولكن التفاعل مع غاز النتروجين لا يحدث عند درجات حرارة أدنى من 380 °س، لذلك فإن السترونتيوم يتفاعل فقط مع أكسجين الهواء عند درجة حرارة الغرفة مشكلاً الأكسيد بشكل فوري.[29] بسبب التفاعلية الكبيرة لهذا العنصر مع الأكسجين والماء لذلك يحفظ في أوان معزولة عن الوسط المحيط مليئة بغاز خامل أو ضمن سوائل هيدروكربونية مثل الزيوت المعدنية أو الكيروسين لمنع فعل الأكسدة. يكون السترونتيوم قادراً على الذوبان في الأمونيا السائلة، مثله الباريوم والكالسبوم وباقي اللانثانيدات مثل اليوروبيوم والإتيربيوم، ويعطي محلولاً ذا لون أزرق داكن.[42]
نظراً لكبر حجم عناصر المستوى الفرعي s الثقيلة مثل السترونتيوم، فإن هناك احتمالات كثيرة للعدد التناسقي [ط 45] تبدأ من 2 أو 3 أو 4 لتنتهي ب22 أو 24 في مركبات مثل SrCd11 وSrZn13. وبما أن الأيون 2+Sr كبير الحجم نسبياً، لذا يميل السترونتيوم لحيازة عدد تناسقي كبير في المركبات الكيميائية.[44] يقوم الحجم الكبير لذرات السترونتيوم بدور مهم في استقرار معقدات السترونتيوم مع الربيطات الضخمة متعددة السن [ط 46] مثل الإيثرات التاجية [ط 47]، فعلى اسبيل المثال يكون معقد 18-تاج-6 مع السترونتيوم والباريوم أكثر استقراراً بشكل كبير بالمقارنة مع الكالسيوم.[45]
المركبات الكيميائية[عدل]
يكون للسترونتيوم حالة الأكسدة +2 في أغلب مركباته الكيميائية، وغالباً ما تكون مركباته عديمة اللون، وذات انحلالية جيدة في الماء.
- المركبات اللاعضوية
إلى جانب الأكسيد البسيط (أكسيد السترونتيوم) SrO، فإن السترونتيوم قادر على تشكيل البيروكسيد SrO2 من الأكسدة المباشرة لفلز السترونتيوم بوجود ضغط مرتفع من غاز الأكسجين، وهناك دلائل على إمكانية تشكل فوق أكسيد Sr(O2)2 أيضاً.[46] يعد هيدروكسيد السترونتيوم Sr(OH)2 من القواعد الكيميائية القوية، ولكنه ليس بدرجة قوة هيدروكسيد الباريوم أو هيدروكسيدات الفلزات القلوية.[47]
إن جميع هاليدات السترونتيوم هي من المركبات المعروفة،[48] وهي على النمط SrX2 مع الفلور والكلور والبروم واليود. وهي مركبات عديمة اللون تنتج من التفاعل بين ملح الكربونات مع أحماض هاليد الهيدروجين الموافقة، مثل حمض الهيدروفلوريك أو حمض الهيدروكلوريك؛ ولهذه المركبات تطبيقات مختلفة، من ضمنها استخدامها في تركيب معاجين الأسنان.[49] كما يشكل السترونتيوم أغلب الأملاح الأنيونية الأكسجينية مثل كربونات السترونتيوم SrCO3 أو نترات السترونتيوم Sr(NO3)2 أو كبريتات السترونتيوم SrSO4 أو كرومات السترونتيوم SrCrO4. يعد كربونات السترونتيوم من المركبات الكيميائية المهمة لهذا العنصر، وهو أكثر الأشكال تداولاً على النطاق التجاري، وله العديد من التطبيقات المختلفة.[50]
تتميز مركبات السترونتيوم الأحادي (حالة الأكسدة +1) بأنها مركبات غير مستقرة؛ لمركب هيدروكسيد السترونتيوم الأحادي SrOH خواص قريبة من كلوريد السترونتيوم الأحادي SrCl.[51]
- المركبات العضوية
تحوي مركبات السترونتيوم العضوية على رابطة كيميائية واحدة على الأقل بين عنصري السترونتيوم والكربون Sr-C.[52] تتشكل هذه المركبات على هيئة مركبات وسطية في تفاعلات باربييه [ط 48].[53][54][55] على الرغم من انتماء المغنسيوم والسترونتيوم لذات المجموعة من الفلزات القلوية الترابية، إلا أن مركبات المغنيسيوم العضوية أكثر انتشاراً وشيوعاً لسهولة تحضيرها وتطبيقاتها المختلفة؛ أما مركبات السترونتيوم العضوية فهي صعبة التحضير وذات نشاط كيميائي كبير. تحضر هذه المركبات عادة عند درجات حرارة منخفضة، وغالباً ما تفضل الربيطات ذات الحجم الكبير، مثل ثنائي حلقي بنتاديينيل السترونتيوم Sr(C5H5)2، والذي يكون عند وجود مستبدل من C5(CH3)5 الضخم، أكثر استقراراً.[56]
الدور الحيوي[عدل]
هناك عدد قليل من الكائنات الحية التي يدخل السترونتيوم في عملياتها الحيوية،[57][58] من ضمنها الأكانثاريا [ط 49]، وهي مجموعة كبيرة نسبياً من الكائنات الأولية الشعوعية [ط 50] البحرية، والتي تنتج مركب كبريتات السترونتيوم وتستخدمه في تركيب هيكلها البنائي.[59] كما تستطيع أنواع طحالب الدسميديات [ط 51] (مثل النجيمية [ط 52]) أن تمعدن حيوياً [ط 53] السترونتيوم والباريوم من الوسط المحيط وأن تخزنها على هيئة بلورات دقيقة.[60][61]
لا يصنف السترونتيوم ضمن المغذيات الضرورية [ط 54] بالنسبة لجسم الإنسان. ولكن من جهة أخرى أبدت بعض التجارب على الحيوانات أن التراكيز المرتفعة للسترونتيوم في الغذاء تأثير سلبي على الصحة.[62] يتراكم السترونيوم في جسم الإنسان.[63] وبالرغم من ذلك فإنه يدخل في تركيب بعض المكملات الغذائية [ط 55].[64][65] وذلك على شكل كلوريد السترونتيوم، ولا توجد دراسات كافية على مخاطر تناول السترونتيوم فموياً، ولذلك ينبغي تجنب تناوله من غير استشارة طبية، وخاصة من أولئك الذين لديهم تاريخ مرضي في العائلة فيما يخص الاضطرابات القلبية. [64][65] يتركز أغلب السترونتيوم الممتص في العظام؛ إذ يمتص الجسم السترونتيوم بشكل مماثل لامتصاص الكالسيوم، وذلك للتشابه الكيميائي الكبير بينهما. ويمكن للإنسان العادي أن يمتص مقداراً وسطياً من السترونتيوم يراوح 2 ميليغرام يومياً.[66] تبلغ النسبة بين السترونتيوم إلى الكالسيوم في عظام الإنسان ما بين 1:1000 إلى 1:2000، وهي تقريباً مماثلة للنسبة بينهما في مصل الدم.[67] وجد أن السترونتيوم الممتص من البالغين يكون متوضعاً على أسطح العظام؛ بالمقابل فإن السترونتيوم الممتص من الأطفال يدخل إلى بنية العظم ويحل مكان الكالسيوم في العظام النامية، مما يؤدي إلى حدوث مشاكل في نمو العظام.[68]
هناك تفاوت كبير في تقدير عمر النصف الحيوي [ط 56] للسترونتيوم في جسم الإنسان، فهناك دراسات تحدده بين 14-600 يوم؛[69][70] أو 1000 يوم،[71] أو 18 سنة،[72] أو 30 سنة،[73] وذلك إلى حد أعلى أقصى مقداره 49 سنة.[74] يعود سبب ذلك التفاوت الكبير في تقدير عمر النصف الحيوي للسترونتيوم إلى الآلية المعقدة لاستقلاب (أيض) السترونتيوم داخل جسم الإنسان. ولكن القيمة المتوسطة لإجمالي تلك التقديرات هي في مجال 18 سنة.[75] يعتمد معدل طرح السترونتيوم من الجسم على عدة عوامل، من ضمنها العمر والجنس ووجود تباينات في تجدد العظام [ط 57].[76]
يساعد العقار الدوائي رانيلات السترونتيوم [ط 58] على نمو العظام، إذ يسهم في تعزيز كثافة العظام ويقلل من احتمالية حدوث الكسور وخاصة في حالات هشاشة العظام[ط 59].[77][78] ولكن هذا العقار يزيد بالمقابل من خطورة حدوث اضطرابات جسدية من الخثار الوريدي [ط 60] أو الانصمام رئوي [ط 61] أو اضطرابات وعائية مثل النوبة القلبية [ط 62]؛ لذلك لا يعطى هذا الدواء من غير وصفة طبية في حالات محددة.[79] يظهر السترونتيوم مقدرة على تثبيط التهيج الحسي [ط 63] عندما يطبق موضعياً على الجلد؛[80][81] إذ يساعد على تسريع معدل نقاهة [ط 64] حاجز نفاذية البشرة [ط 65].[82]
المخاطر[عدل]
| سترونتيوم | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |   |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H261, H315 |
| بيانات وقائية وفق GHS | P223, P231+232, P370+378, P422[83] |
| NFPA 704 |
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
إن مسحوق السترونتيوم تلقائي الاشتعال، ويتفاعل بعنف مع الرطوبة والماء. لذا لا يمكن استخدام الماء أو رغوة ثنائي أكسيد الكربون من أجل إخماد حرائق السترونتيوم، ولكن يجب استخدام مطافئ الرمل أو الملح.
الأثر البيئي[عدل]
يعد النظير سترونتيوم-90 90Sr من النظائر المشعّة وهو ناتج انشطار نووي في المفاعلات النووية في محطات الطاقة النووية. يعد هذا النظير مكوناً رئيسياً من مكونات المخلفات الإشعاعية [ط 66] والوقود النووي المستهلك [ط 67]. سببت كارثة تشيرنوبل سنة 1986 في تلوث مساحة مقدارها 30 ألف كم2 بالنظير سترونتيوم-90 بنشاط أكبر من 10 كيلوبيكريل/متر مربع، وذلك يعادل حوالي 5% من 90Sr الذي كان موجوداً في قلب المفاعل النووي.[84]
يبلغ عمر النصف للنظير سترونتيوم-90 مقدار 29 سنة، وهو قصير بالشكل الكافي ليجد له تطبيقات عملية مثل استخدامه في بطاريات حرارية خاصة [ط 68]، ولكنه بالمقابل طويل بالشكل الكافي الذي يستلزم مئات السنوات كي يضمحل إلى مستويات آمنة. إذ أن التعرض إلى الماء والغذاء الملوث بهذا النظير يزيد من خطورة الإصابة بأمراض سرطانية مثل ابيضاض الدم وسرطان العظم؛[85] بالإضافة إلى فرط نشاط جارة الدرقية الأولي [ط 69].[86]
بينت الدراسات أن للطحالب [ط 70] انتقائية تجاه السترونتيوم، في حين أن معظم النباتات المستخدمة من أجل المعالجة الحيوية [ط 71] لم تظهر تلك الانتقائية بين السترونتيوم والكالسيوم، إذ كانت تتشبع بالكالسيوم لوجوده بكميات فائضة في المخلفات الإشعاعية.[85] لذلك ركز الباحثون على أنواع من الطحالب الخضراء [ط 72] التي تستطيع أن تراكم السترونتيوم حيوياً في مياه صرف، وأظهرت انتقائية عالية في سعة الامتزاز الحيوي [ط 73]، بالشكل الذي يمكن أن يرشحها أن تستخدم في معالجة المخلفات الإشعاعية.[87]
الاستخدامات[عدل]

كان التطبيق الرئيسي للسترونتيوم في الماضي (حوالي 75% من الإنتاج العالمي) هو دخوله في تركيب شاشات أجهزة التلفاز الحاوية على صمام الأشعة المهبطية [ط 74].[34] إذ كان يسهم في حجب انبعاثات الأشعة السينية،[88][89] فقد كان على جميع مكونات صمام الأشعة المهبطية أن تكون قادرة على امتصاص الأشعة السينية، لذلك كان الزجاج المستخدم في مكان العنق والقمع في ذلك الصمام مصنوعاً من الزجاج الرصاصي [ط 75]، ولكن ذلك النوع من الزجاج كان يظهر أثراً بني اللون نتيجة التآثر مع الأشعة السينية. لذلك الغرض، كان القسم الأمامي يصنع من زجاج من نوع آخر حاو على أكاسيد السترونتيوم والباريوم من أجل امتصاص الأشعة السينية.[90] تضاءل استخدام السترونتيوم مع تطوير الشاشات المسطحة، الأمر الذي أدى إلى انخفاض الكميات المستخرجة من السترونتيوم في عمليات التعدين.[32]
بسبب الشبه الكيميائي بين الكالسيوم والسترونتيوم، وتركز الأخير في العظام عند امتصاصه، لذلك يستخدم التوزع الطبيعي لنظائر السترونتيوم وعلاقته بالموقع الجغرافي في الاستفادة من تحديد أصل العظام عند تحليلها في الدراسات التاريخية.[91][92] يساهم هذا الأسلوب العلمي في تحديد أنماط الهجرات البشرية [ط 76] القديمة، وفي تحديد أصل الرفات البشري المخلوط [ط 77] في مواقع الدفن في ساحات المعارك.[93] وكذلك يطبق ذات الأسلوب من أجل تتبع هجرات الحيوانات.[94][95]
تستخدم نسبة النظير سترونتيوم-87 87Sr إلى النظير سترونتيوم-86 86Sr في تحديد أصل الصخور الرسوبية [ط 78] في الموائل البحرية والنهرية.[96] وطبق هذا المنهج في نظام الطبيعي لحوص النيل والمتوسط؛[97][98][99] فبسبب الاختلاف في عمر الصخور المكونة للنيل الأزرق والنيل الأبيض، بالتالي يمكن تحديد أصل الصخور في مناطق الاستجماع [ط 79] الواصلة إلى دلتا النيل وبحر المتوسط الشرقي؛ وتلك التغيرات كانت خاضعة لتأثير المناخ في العصر الهولوسيني [ط 80].[97] استخدم منهج النسبة بين نظيري السترونتيوم أيضاً في تحديد أصل المواد الأثرية في محمية تشاكو كالتشر التاريخية الوطنية [ط 81].[100][101]

لمركبات السترونتيوم تطبيقات مختلفة، إذ يستخدم ألومينات السترونتيوم في تركيب الأغراض والأشياء الفسفورية؛[102] أما كربونات السترونتيوم فيكثر استخدامه، ضمن أملاح سترونتيوم أخرى، في صناعة مواد المشاعل،[29] وفي تركيب الألعاب النارية لإضفاء لون أحمر داكن، ويستهلك هذا التطبيق حوالي 5% من الإنتاج العالمي للسترونتيوم.[34] في تطبيق آخر، يستخدم مركب كربونات السترونتيوم في صناعة مغانط الفرّيت الصلبة [ط 82].[103][104] ويستخدم كلوريد السترونتيوم أحياناً في تركيب معاجين الأسنان، كما تستخدم كميات ضئيلة من تنقية الزنك وإزالة شوائب الرصاص.[29] يستخدم السترونتيوم في بعض الأحيان مادة مستأصلة [ط 83] من أجل إزالة الغازات غير المرغوبة في الفراغ، على الرغم من أفضلية الباريوم في هذا التطبيق.[105]

من جهة أخرى، وبالنسبة لنظائر السترونتيوم، فللنظير السترونتيوم 87Sr تطبيق في مجال البحث العلمي في البنى فائقة الدقة [ط 84] في الساعات الذرية.[106] أما النظير سترونتيوم-89 فهو المكوّن الفعّال [ط 85] في عقار ميتاسترون [ط 86]،[107] وهو دواء مشع [ط 87] يستخدم من أجل معالجة انبثاث [ط 88] سرطان العظم.[39]
يستخدم النظير سترونتيوم-90 من أجل توليد الطاقة في بطاريات النظائر المشعة، إذ ينتج كل غرام واجد منه ما يعادل 0.93 واط من الحرارة؛[108] ويتميز بكونه أرخص بكثير من نظير البلوتونيوم 238Pu؛ ولكن نظراً لإصداره أشعة انكباح [ط 89] في مجال الأشعة السينية، لذلك ينبغي عزله وحجبه بالشكل الكافي عند استخدامه مصدراً حرارياً. شاع استخدام تلك البطاريات في عهد الاتحاد السوفيتي، وذلك في المنارات في المناطق القطبية الشمالية.[109][110]
طالع أيضاً[عدل]
الهوامش[عدل]
- ملحوظات
- ^ أو السترونشيوم
- مصطلحات
- ^ Adair Crawford
- ^ William Cruickshank
- ^ Friedrich Gabriel Sulzer
- ^ Johann Friedrich Blumenbach
- ^ Strontianite
- ^ Strontian
- ^ witherite
- ^ Thomas Charles Hope
- ^ strontites
- ^ Martin Heinrich Klaproth
- ^ Richard Kirwan
- ^ Johann Tobias Lowitz
- ^ Humphry Davy
- ^ electrolysis
- ^ strontium
- ^ Augustin-Pierre Dubrunfaut
- ^ Strontian process
- ^ Granada basin
- ^ parts per million (ppm)
- ^ coprecipitate
- ^ calcite
- ^ anhydrite
- ^ Cation-exchange
- ^ leaching
- ^ Roasting
- ^ carbothermic reduction
- ^ black ash
- ^ Aluminothermic reaction
- ^ Radiogenic nuclide
- ^ Beta decay
- ^ rubidium–strontium dating
- ^ electron capture
- ^ positron emission
- ^ Electron emission
- ^ half-life
- ^ fission product
- ^ leukemia
- ^ Face-centered cubic crystal system
- ^ Lattice constant
- ^ Formula unit
- ^ Unit cell
- ^ Hexagonal crystal system
- ^ Body-centered cubic
- ^ dendritic
- ^ coordination number
- ^ polydentate macrocyclic ligands
- ^ crown ether
- ^ Barbier reactions
- ^ Acantharea
- ^ radiolarian protozoa
- ^ Desmidiales
- ^ Micrasterias
- ^ Biomineralization
- ^ Essential nutrient
- ^ Dietary supplement
- ^ biological half-life
- ^ Bone remodeling/bone metabolism
- ^ strontium ranelate
- ^ Osteoporosis
- ^ Venous thrombosis
- ^ Pulmonary embolism
- ^ myocardial infarction
- ^ inhibit sensory irritation
- ^ recovery rate
- ^ epidermal permeability barrier
- ^ nuclear waste
- ^ spent nuclear fuel
- ^ radioisotope thermoelectric generator
- ^ primary hyperparathyroidism
- ^ Algae
- ^ bioremediation
- ^ Scenedesmus spinosus
- ^ biosorption
- ^ cathode-ray tube
- ^ lead glass
- ^ Human migrations
- ^ commingled human remains
- ^ Sedimentary rocks
- ^ catchment areas
- ^ Holocene
- ^ Chaco Culture National Historical Park
- ^ hard ferrite magnets
- ^ getter
- ^ Hyperfine structure
- ^ active ingredient
- ^ Metastron
- ^ radiopharmaceutical
- ^ Metastasis
- ^ Bremstrahlung
المراجع[عدل]
- ^ P. Colarusso؛ وآخرون (1996). "High-Resolution Infrared Emission Spectrum of Strontium Monofluoride" (PDF). J. Molecular Spectroscopy. ج. 175: 158.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|author=(مساعدة) - ^ Crawford، Adair (1790). "On the medicinal properties of the muriated barytes". Medical Communications. ج. 2: 301–59. مؤرشف من الأصل في 2024-02-08.
- ^ Murray, W. H. (1977). The Companion Guide to the West Highlands of Scotland. London: Collins. ISBN:978-0-00-211135-5.
- ^ Hans Lüschen (in German), Die Namen der Steine. Das Mineralreich im Spiegel der Sprache, Thun und München: Ott Verlag, pp. 329, 381
- ^ Sulzer، Friedrich Gabriel؛ Blumenbach، Johann Friedrich (1791). "Über den Strontianit, ein Schottisches Foßil, das ebenfalls eine neue Grunderde zu enthalten scheint". Bergmännisches Journal: 433–36. مؤرشف من الأصل في 2024-03-10.
- ^ F. Sulzer: Ueber den Strontianit, ein Schottisches Fossil, das ebenfalls eine neue Grunderde zu enthalten scheint; und über einige andere naturhistorische Merkwürdigkeiten. Aus einem Briefe des Hrn. Rath Sulzer zu Ronneburg mitgetheilt von J. F. Blumenbach. In: Johann Heinrich Voigt (Ed.), Magazin für das Neueste aus der Physik und Naturgeschichte. 8, 3, 1891, S. 68–72 [1] نسخة محفوظة 2024-04-30 على موقع واي باك مشين.
- ^ "Thomas Charles Hope, MD, FRSE, FRS (1766-1844) - School of Chemistry". www.chem.ed.ac.uk. مؤرشف من الأصل في 2024-05-04.
- ^ Doyle, W.P. "Thomas Charles Hope, MD, FRSE, FRS (1766–1844)". The University of Edinburgh. مؤرشف من الأصل في 2 يونيو 2013.
- ^ Hope، Thomas Charles (1798). "Account of a mineral from Strontian and of a particular species of earth which it contains". Transactions of the Royal Society of Edinburgh. ج. 4 ع. 2: 3–39. DOI:10.1017/S0080456800030726. S2CID:251579302. مؤرشف من الأصل في 2024-02-08.
- ^ Murray, T. (1993). "Elementary Scots: The Discovery of Strontium". Scottish Medical Journal. ج. 38 ع. 6: 188–89. DOI:10.1177/003693309303800611. PMID:8146640. S2CID:20396691.
- ^ Hope، Thomas Charles (1794). "Account of a mineral from Strontian and of a particular species of earth which it contains". Transactions of the Royal Society of Edinburgh. ج. 3 ع. 2: 141–49. DOI:10.1017/S0080456800020275. S2CID:251579281. مؤرشف من الأصل في 2024-02-08.
- ^ أ ب Partington، J. R. (1942). "The early history of strontium". Annals of Science. ج. 5 ع. 2: 157. DOI:10.1080/00033794200201411.
- ^ Davy، H. (1808). "Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia". Philosophical Transactions of the Royal Society of London. ج. 98: 333–70. Bibcode:1808RSPT...98..333D. DOI:10.1098/rstl.1808.0023. S2CID:96364168. مؤرشف من الأصل في 2024-02-08.
- ^ Taylor, Stuart (19 يونيو 2008). "Strontian gets set for anniversary". Lochaber News. مؤرشف من الأصل في 13 يناير 2009.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ Weeks, Mary Elvira (1932). "The discovery of the elements: X. The alkaline earth metals and magnesium and cadmium". Journal of Chemical Education. ج. 9 ع. 6: 1046–57. Bibcode:1932JChEd...9.1046W. DOI:10.1021/ed009p1046.
- ^ Partington، J. R. (1951). "The early history of strontium. Part II". Annals of Science. ج. 7: 95. DOI:10.1080/00033795100202211.
- ^ Fachgruppe Geschichte Der Chemie, Gesellschaft Deutscher Chemiker (2005). Metalle in der Elektrochemie. ص. 158–62. مؤرشف من الأصل في 2024-02-08.
- ^ Heriot, T. H. P (2008). "strontium saccharate process". Manufacture of Sugar from the Cane and Beet. Read Books. ISBN:978-1-4437-2504-0.
- ^ Börnchen، Martin. "Der Strontianitbergbau im Münsterland". مؤرشف من الأصل في 11 ديسمبر 2014. اطلع عليه بتاريخ 9 نوفمبر 2010.
- ^ Martin، Josèm؛ Ortega-Huertas، Miguel؛ Torres-Ruiz، Jose (1984). "Genesis and evolution of strontium deposits of the granada basin (Southeastern Spain): Evidence of diagenetic replacement of a stromatolite belt". Sedimentary Geology. ج. 39 ع. 3–4: 281. Bibcode:1984SedG...39..281M. DOI:10.1016/0037-0738(84)90055-1.
- ^ "Chain Fission Yields". iaea.org. مؤرشف من الأصل في 2024-05-02.
- ^ Nordin، B. E. (1968). "Strontium Comes of Age". British Medical Journal. ج. 1 ع. 5591: 566. DOI:10.1136/bmj.1.5591.566. PMC:1985251.
- ^ Turekian، K. K.؛ Wedepohl، K. H. (1961). "Distribution of the elements in some major units of the Earth's crust". Geological Society of America Bulletin. ج. 72 ع. 2: 175–92. Bibcode:1961GSAB...72..175T. DOI:10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2.
- ^ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Abundance of Elements in the Earth’s Crust and in the Sea, S. 14-17
- ^ Webmineral – Mineral Species sorted by the element Sr (Strontium). نسخة محفوظة 2024-05-01 على موقع واي باك مشين.
- ^ Heuel-Fabianek, B. (2014). "Partition Coefficients (Kd) for the Modelling of Transport Processes of Radionuclides in Groundwater" (PDF). Berichte des Forschungszentrums Jülich. ج. 4375. ISSN:0944-2952. مؤرشف من الأصل (PDF) في 2024-03-31.
- ^ Stringfield, V. T. (1966). "Strontium". Artesian water in Tertiary limestone in the southeastern States. Geological Survey Professional Paper. United States Government Printing Office. ص. 138–39.
- ^ Angino، Ernest E.؛ Billings، Gale K.؛ Andersen، Neil (1966). "Observed variations in the strontium concentration of sea water". Chemical Geology. ج. 1: 145. Bibcode:1966ChGeo...1..145A. DOI:10.1016/0009-2541(66)90013-1.
- ^ أ ب ت ث ج ح C. R. Hammond The elements (pp. 4–35) in Lide, D. R.، المحرر (2005)، CRC Handbook of Chemistry and Physics (ط. 86th)، Boca Raton (FL): CRC Press، ISBN:0-8493-0486-5
- ^ Sun، Y.؛ Sun، M.؛ Lee، T.؛ Nie، B. (2005). "Influence of seawater Sr content on coral Sr/Ca and Sr thermometry". Coral Reefs. ج. 24: 23. DOI:10.1007/s00338-004-0467-x. S2CID:31543482.
- ^ Kogel، Jessica Elzea؛ Trivedi، Nikhil C.؛ Barker، James M. (5 مارس 2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses. ISBN:978-0-87335-233-8. مؤرشف من الأصل في 2024-02-08.
- ^ أ ب Ober، Joyce A. "Mineral Commodity Summaries 2010: Strontium" (PDF). United States Geological Survey. مؤرشف من الأصل (PDF) في 2024-05-02. اطلع عليه بتاريخ 2010-05-14.
- ^ أ ب Ober، Joyce A. "Mineral Commodity Summaries 2015: Strontium" (PDF). United States Geological Survey. مؤرشف من الأصل (PDF) في 2024-05-02. اطلع عليه بتاريخ 2016-03-26.
- ^ أ ب ت ث ج ح MacMillan, J. Paul; Park, Jai Won; Gerstenberg, Rolf; Wagner, Heinz; Köhler, Karl and Wallbrecht, Peter (2002) "Strontium and Strontium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a25_321.
- ^ Strontium. In: U.S. Geological Survey: Mineral Commodity Summaries. 2022. نسخة محفوظة 2024-05-02 على موقع واي باك مشين.
- ^ Kemal، Mevlüt؛ Arslan، V.؛ Akar، A.؛ Canbazoglu، M. (1996). Production of SrCO3 by black ash process: Determination of reductive roasting parameters. CRC Press. ص. 401. ISBN:978-90-5410-829-0. مؤرشف من الأصل في 2024-02-08.
- ^ Greenwood & Earnshaw 1997، صفحات 19.
- ^ Halperin، Edward C.؛ Perez، Carlos A.؛ Brady، Luther W. (2008). Perez and Brady's principles and practice of radiation oncology. Lippincott Williams & Wilkins. ص. 1997–. ISBN:978-0-7817-6369-1. مؤرشف من الأصل في 2024-02-08. اطلع عليه بتاريخ 2011-07-19.
- ^ أ ب Bauman، Glenn؛ Charette، Manya؛ Reid، Robert؛ Sathya، Jinka (2005). "Radiopharmaceuticals for the palliation of painful bone metastases – a systematic review". Radiotherapy and Oncology. ج. 75 ع. 3: 258.E1–258.E13. DOI:10.1016/j.radonc.2005.03.003. PMID:16299924.
- ^ "Strontium | Radiation Protection | US EPA". United States Environmental Protection Agency (EPA). 24 أبريل 2012. مؤرشف من الأصل في 2024-02-08. اطلع عليه بتاريخ 2012-06-18.
- ^ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1238
- ^ أ ب Greenwood & Earnshaw 1997، صفحات 112–113.
- ^ K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. B30, 1974, S. 193–204, doi:10.1107/S0567740874002469.
- ^ Greenwood & Earnshaw 1997، صفحات 115.
- ^ Greenwood & Earnshaw 1997، صفحات 124.
- ^ Greenwood & Earnshaw 1997، صفحات 119.
- ^ Greenwood & Earnshaw 1997، صفحات 121.
- ^ Greenwood & Earnshaw 1997، صفحات 117.
- ^ Klaus-Dieter Hellwege: Die Praxis der zahnmedizinischen Prophylaxe: Ein Leitfaden für die Individualprophylaxe, Gruppenprophylaxe und Initiale Parodontaltherapie. 6. Auflage. Thieme Verlag, 2003, ISBN 3-13-127186-8, S. 164.
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعullmann - ^ Jesse J. Sabatini, Ernst-Christian Koch, Jay C. Poret, Jared D. Moretti, Seth M. Harbol: Rote pyrotechnische Leuchtsätze – ohne Chlor! In: Angewandte Chemie. 127, 2015, S. 11118–11120, doi:10.1002/ange.201505829.
- ^ Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 69–70.
- ^ Miyoshi، N.؛ Kamiura، K.؛ Oka، H.؛ Kita، A.؛ Kuwata، R.؛ Ikehara، D.؛ Wada، M. (2004). "The Barbier-Type Alkylation of Aldehydes with Alkyl Halides in the Presence of Metallic Strontium". Bulletin of the Chemical Society of Japan. ج. 77 ع. 2: 341. DOI:10.1246/bcsj.77.341.
- ^ Miyoshi، N.؛ Ikehara، D.؛ Kohno، T.؛ Matsui، A.؛ Wada، M. (2005). "The Chemistry of Alkylstrontium Halide Analogues: Barbier-type Alkylation of Imines with Alkyl Halides". Chemistry Letters. ج. 34 ع. 6: 760. DOI:10.1246/cl.2005.760.
- ^ Miyoshi، N.؛ Matsuo، T.؛ Wada، M. (2005). "The Chemistry of Alkylstrontium Halide Analogues, Part 2: Barbier-Type Dialkylation of Esters with Alkyl Halides". European Journal of Organic Chemistry. ج. 2005 ع. 20: 4253. DOI:10.1002/ejoc.200500484.
- ^ Greenwood & Earnshaw 1997، صفحات 136–137.
- ^ Pors Nielsen، S. (2004). "The biological role of strontium". Bone. ج. 35 ع. 3: 583–88. DOI:10.1016/j.bone.2004.04.026. PMID:15336592.
- ^ Colette Febvre, Jean Febvre, Anthony Michaels: Acantharia. In: John J. Lee, Gordon F. Leedale, Phyllis Bradbury (Hrsg.): Illustrated Guide to the Protozoa. 2. Auflage. Band 2, Society of Protozoologists, Lawrence, Kansas 2000, ISBN 1-891276-23-9, S. 783–803.
- ^ De Deckker، Patrick (2004). "On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios". Hydrobiologia. ج. 517 ع. 1–3: 1. DOI:10.1023/B:HYDR.0000027333.02017.50. S2CID:42526332.
- ^ Martin Niedermeier, Notburga Gierlinger, UrsulaLütz-Meindla: Biomineralization of strontium and barium contributes to detoxification in the freshwater alga Micrasterias. In: Journal of Plant Physiology, Band 230, November 2018, S. 80–91
- ^ Minna R Krejci, Brian Wasserman, Lydia Finney, Ian McNulty, Daniel Legnini, Stefan Vogt, Derk Joester: Selectivity in biomineralization of barium and strontium. In: Journal of Structural Biology, Band 176(2), November 2011, S. 192–202
- ^ J. C. Bartley, E. F. Reber: Toxic Effects of Stable Strontium in Young Pigs. In: J. Nutr. 75, 1, 1961, S. 21–28; (Volltext)- نسخة محفوظة 2022-10-06 على موقع واي باك مشين.
- ^ Price، Charles T.؛ Langford، Joshua R.؛ Liporace، Frank A. (5 أبريل 2012). "Essential Nutrients for Bone Health and a Review of their Availability in the Average North American Diet". Open Orthop. J. ج. 6: 143–49. DOI:10.2174/1874325001206010143. PMC:3330619. PMID:22523525.
- ^ أ ب "Strontium". WebMD. مؤرشف من الأصل في 2024-02-08. اطلع عليه بتاريخ 2017-11-20.
- ^ أ ب "Strontium for Osteoporosis". WebMD. مؤرشف من الأصل في 2024-04-20. اطلع عليه بتاريخ 2017-11-20.
- ^ Emsley، John (2011). Nature's building blocks: an A–Z guide to the elements. Oxford University Press. ص. 507. ISBN:978-0-19-960563-7.
- ^ Cabrera، Walter E.؛ Schrooten، Iris؛ De Broe، Marc E.؛ d'Haese، Patrick C. (1999). "Strontium and Bone". Journal of Bone and Mineral Research. ج. 14 ع. 5: 661–68. DOI:10.1359/jbmr.1999.14.5.661. PMID:10320513. S2CID:32627349.
- ^ Agency for Toxic Substances and Disease Registry (26 مارس 2014). "Strontium | Public Health Statement | ATSDR". cdc.gov. Agency for Toxic Substances and Disease Registry. اطلع عليه بتاريخ 2024-01-12.
- ^ Tiller، B. L. (2001)، "4.5 Fish and Wildlife Surveillance" (PDF)، Hanford Site 2001 Environmental Report، DOE، مؤرشف من الأصل (PDF) في 2013-05-11، اطلع عليه بتاريخ 2014-01-14
- ^ Driver، C. J. (1994)، Ecotoxicity Literature Review of Selected Hanford Site Contaminants (PDF)، DOE، DOI:10.2172/10136486، اطلع عليه بتاريخ 2014-01-14
- ^ "Freshwater Ecology and Human Influence". Area IV Envirothon. مؤرشف من الأصل في 1 يناير 2014. اطلع عليه بتاريخ 14 يناير 2014.
- ^ "Radioisotopes That May Impact Food Resources" (PDF). Epidemiology, Health and Social Services, State of Alaska. مؤرشف من الأصل في 21 أغسطس 2014. اطلع عليه بتاريخ 14 يناير 2014.
{{استشهاد ويب}}: صيانة الاستشهاد: BOT: original URL status unknown (link) - ^ "Human Health Fact Sheet: Strontium" (PDF). Argonne National Laboratory. أكتوبر 2001. مؤرشف من الأصل (PDF) في 24 يناير 2014. اطلع عليه بتاريخ 14 يناير 2014.
- ^ "Biological Half-life". HyperPhysics. اطلع عليه بتاريخ 2014-01-14.
- ^ Glasstone، Samuel؛ Dolan، Philip J. (1977). "XII: Biological Effects" (PDF). The effects of Nuclear Weapons. ص. 605. اطلع عليه بتاريخ 2014-01-14.
- ^ Shagina، N. B.؛ Bougrov، N. G.؛ Degteva، M. O.؛ Kozheurov، V. P.؛ Tolstykh، E. I. (2006). "An application of in vivo whole body counting technique for studying strontium metabolism and internal dose reconstruction for the Techa River population". Journal of Physics: Conference Series. ج. 41 ع. 1: 433–40. Bibcode:2006JPhCS..41..433S. DOI:10.1088/1742-6596/41/1/048. S2CID:32732782.
- ^ Meunier P. J.؛ Roux C.؛ Seeman E.؛ Ortolani، S.؛ Badurski، J. E.؛ Spector، T. D.؛ Cannata، J.؛ Balogh، A.؛ Lemmel، E. M.؛ Pors-Nielsen، S.؛ Rizzoli، R.؛ Genant، H. K.؛ Reginster، J. Y. (يناير 2004). "The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis" (PDF). New England Journal of Medicine. ج. 350 ع. 5: 459–68. DOI:10.1056/NEJMoa022436. hdl:2268/7937. PMID:14749454. مؤرشف من الأصل (PDF) في 2024-02-08.
- ^ Reginster JY؛ Seeman E؛ De Vernejoul MC؛ Adami، S.؛ Compston، J.؛ Phenekos، C.؛ Devogelaer، J. P.؛ Diaz Curiel، M.؛ Sawicki، A.؛ Goemaere، S.؛ Sorensen، O. H.؛ Felsenberg، D.؛ Meunier، P. J. (مايو 2005). "Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: treatment of peripheral osteoporosis (TROPOS) study" (PDF). The Journal of Clinical Endocrinology & Metabolism. ج. 90 ع. 5: 2816–22. DOI:10.1210/jc.2004-1774. PMID:15728210.
- ^ "Strontium ranelate: cardiovascular risk – restricted indication and new monitoring requirements". Medicines and Healthcare products Regulatory Agency, UK. مارس 2014.
- ^ Hahn, G.S. (1999). "Strontium Is a Potent and Selective Inhibitor of Sensory Irritation" (PDF). Dermatologic Surgery. ج. 25 ع. 9: 689–94. DOI:10.1046/j.1524-4725.1999.99099.x. PMID:10491058. مؤرشف من الأصل (PDF) في 31 مايو 2016.
- ^ Hahn, G.S. (2001). Anti-irritants for Sensory Irritation. ص. 285. ISBN:978-0-8247-0292-2.
{{استشهاد بكتاب}}:|صحيفة=تُجوهل (مساعدة) - ^ Kim, Hyun Jeong؛ Kim, Min Jung؛ Jeong, Se Kyoo (2006). "The Effects of Strontium Ions on Epidermal Permeability Barrier". The Korean Dermatological Association, Korean Journal of Dermatology. ج. 44 ع. 11: 1309. مؤرشف من الأصل في 2021-06-04. اطلع عليه بتاريخ 2014-03-31.
- ^ "Strontium 343730". Sigma-Aldrich.
- ^ "Chernobyl: Assessment of Radiological and Health Impact, 2002 update; Chapter I – The site and accident sequence". OECD-NEA. 2002. مؤرشف من الأصل (PDF) في 2024-04-18. اطلع عليه بتاريخ 2015-06-03.
- ^ أ ب Potera، Carol (2011). "HAZARDOUS WASTE: Pond Algae Sequester Strontium-90". Environ Health Perspect. ج. 119 ع. 6: A244. DOI:10.1289/ehp.119-a244. PMC:3114833. PMID:21628117.
- ^ Boehm، BO؛ Rosinger، S؛ Belyi، D؛ Dietrich، JW (18 أغسطس 2011). "The parathyroid as a target for radiation damage". The New England Journal of Medicine. ج. 365 ع. 7: 676–8. DOI:10.1056/NEJMc1104982. PMID:21848480.
- ^ Liu، Mingxue؛ Dong، Faqin؛ Kang، Wu؛ Sun، Shiyong؛ Wei، Hongfu؛ Zhang، Wei؛ Nie، Xiaoqin؛ Guo، Yuting؛ Huang، Ting؛ Liu، Yuanyuan (2014). "Biosorption of Strontium from Simulated Nuclear Wastewater by Scenedesmus spinosus under Culture Conditions: Adsorption and Bioaccumulation Processes and Models". Int J Environ Res Public Health. ج. 11 ع. 6: 6099–6118. DOI:10.3390/ijerph110606099. PMC:4078568. PMID:24919131.
- ^ "Cathode Ray Tube Glass-To-Glass Recycling" (PDF). ICF Incorporated, USEP Agency. مؤرشف من الأصل (PDF) في 2008-12-19. اطلع عليه بتاريخ 2012-01-07.
- ^ Ober، Joyce A.؛ Polyak, Désirée E. "Mineral Yearbook 2007: Strontium" (PDF). United States Geological Survey. اطلع عليه بتاريخ 2008-10-14.
- ^ Méar، F.؛ Yot، P.؛ Cambon، M.؛ Ribes، M. (2006). "The characterization of waste cathode-ray tube glass". Waste Management. ج. 26 ع. 12: 1468–76. Bibcode:2006WaMan..26.1468M. DOI:10.1016/j.wasman.2005.11.017. PMID:16427267.
- ^ Price، T. Douglas؛ Schoeninger، Margaret J.؛ Armelagos، George J. (1985). "Bone chemistry and past behavior: an overview". Journal of Human Evolution. ج. 14 ع. 5: 419–47. DOI:10.1016/S0047-2484(85)80022-1.
- ^ Steadman، Luville T.؛ Brudevold، Finn؛ Smith، Frank A. (1958). "Distribution of strontium in teeth from different geographic areas". The Journal of the American Dental Association. ج. 57 ع. 3: 340–44. DOI:10.14219/jada.archive.1958.0161. PMID:13575071.
- ^ Schweissing، Matthew Mike؛ Grupe، Gisela (2003). "Stable strontium isotopes in human teeth and bone: a key to migration events of the late Roman period in Bavaria". Journal of Archaeological Science. ج. 30 ع. 11: 1373–83. Bibcode:2003JArSc..30.1373S. DOI:10.1016/S0305-4403(03)00025-6.
- ^ Barnett-Johnson, Rachel؛ Grimes، Churchill B.؛ Royer، Chantell F.؛ Donohoe، Christopher J. (2007). "Identifying the contribution of wild and hatchery Chinook salmon (Oncorhynchus tshawytscha) to the ocean fishery using otolith microstructure as natural tags". Canadian Journal of Fisheries and Aquatic Sciences. ج. 64 ع. 12: 1683–92. DOI:10.1139/F07-129. S2CID:54885632. مؤرشف من الأصل في 2024-02-08.
- ^ Porder, S.؛ Paytan, A. & E.A. Hadly (2003). "Mapping the origin of faunal assemblages using strontium isotopes". Paleobiology. ج. 29 ع. 2: 197–204. DOI:10.1666/0094-8373(2003)029<0197:MTOOFA>2.0.CO;2. S2CID:44206756.
- ^ Dasch، J. (1969). "Strontium isotopes in weathering profiles, deep-sea sediments, and sedimentary rocks". Geochimica et Cosmochimica Acta. ج. 33 ع. 12: 1521–52. Bibcode:1969GeCoA..33.1521D. DOI:10.1016/0016-7037(69)90153-7.
- ^ أ ب Krom، M. D.؛ Cliff، R.؛ Eijsink، L. M.؛ Herut، B.؛ Chester، R. (1999). "The characterisation of Saharan dusts and Nile particulate matter in surface sediments from the Levantine basin using Sr isotopes". Marine Geology. ج. 155 ع. 3–4: 319–30. Bibcode:1999MGeol.155..319K. DOI:10.1016/S0025-3227(98)00130-3.
- ^ Krom، Michael D.؛ Stanley، J. Daniel؛ Cliff، Robert A.؛ Woodward، Jamie C. (2002). "Nile River sediment fluctuations over the past 7000 yr and their key role in sapropel development". Geology. ج. 30 ع. 1: 71–74. Bibcode:2002Geo....30...71K. DOI:10.1130/0091-7613(2002)030<0071:NRSFOT>2.0.CO;2.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: التاريخ والسنة (link) - ^ Talbot, M. R.؛ وآخرون (2000). "Strontium isotope evidence for late Pleistocene reestablishment of an integrated Nile drainage network". Geology. ج. 28 ع. 4: 343–46. Bibcode:2000Geo....28..343T. DOI:10.1130/0091-7613(2000)28<343:SIEFLP>2.0.CO;2.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة الاستشهاد: التاريخ والسنة (link) - ^ Benson, L.؛ Cordell, L.؛ Vincent, K.؛ Taylor, H.؛ Stein, J.؛ Farmer, G. & Kiyoto, F. (2003). "Ancient maize from Chacoan great houses: where was it grown?". Proceedings of the National Academy of Sciences. ج. 100 ع. 22: 13111–15. Bibcode:2003PNAS..10013111B. DOI:10.1073/pnas.2135068100. PMC:240753. PMID:14563925.
- ^ English NB؛ Betancourt JL؛ Dean JS؛ Quade J. (أكتوبر 2001). "Strontium isotopes reveal distant sources of architectural timber in Chaco Canyon, New Mexico". Proc Natl Acad Sci USA. ج. 98 ع. 21: 11891–96. Bibcode:2001PNAS...9811891E. DOI:10.1073/pnas.211305498. PMC:59738. PMID:11572943.
- ^ Van der Heggen، David (أكتوبر 2022). "Persistent Luminescence in Strontium Aluminate: A Roadmap to a Brighter Future". Advanced Functional Materials. ج. 32 ع. 52. DOI:10.1002/adfm.202208809. hdl:1854/LU-01GJ1338HX6QQBT438E4QW442N. S2CID:253347258. مؤرشف من الأصل في 2024-02-08. اطلع عليه بتاريخ 2023-04-21.
- ^ "Ferrite Permanent Magnets". Arnold Magnetic Technologies. مؤرشف من الأصل في 14 مايو 2012. اطلع عليه بتاريخ 18 يناير 2014.
- ^ "Barium Carbonate". Chemical Products Corporation. مؤرشف من الأصل في 6 أكتوبر 2014. اطلع عليه بتاريخ 18 يناير 2014.
- ^ Greenwood & Earnshaw 1997، صفحات 111.
- ^ Cartlidge, Edwin (28 Feb 2018). "With better atomic clocks, scientists prepare to redefine the second". Science | AAAS (بالإنجليزية). Archived from the original on 2024-02-08. Retrieved 2019-02-10.
- ^ "FDA ANDA Generic Drug Approvals". Food and Drug Administration. مؤرشف من الأصل في 2024-02-08.
- ^ "What are the fuels for radioisotope thermoelectric generators?". qrg.northwestern.edu. مؤرشف من الأصل في 2024-02-08.
- ^ Doyle, James (30 يونيو 2008). Nuclear safeguards, security and nonproliferation: achieving security with technology and policy. Elsevier. ص. 459. ISBN:978-0-7506-8673-0. مؤرشف من الأصل في 2024-02-08.
- ^ O'Brien، R. C.؛ Ambrosi، R. M.؛ Bannister، N. P.؛ Howe، S. D.؛ Atkinson، H. V. (2008). "Safe radioisotope thermoelectric generators and heat sources for space applications". Journal of Nuclear Materials. ج. 377 ع. 3: 506–21. Bibcode:2008JNuM..377..506O. DOI:10.1016/j.jnucmat.2008.04.009.
المعلومات الكاملة للمصادر[عدل]
- Greenwood، N. N.؛ Earnshaw، A. (1997). Chemistry of the Elements (ط. 2nd). Butterworth-Heinemann. ISBN:978-0-08-037941-8.
| في كومنز صور وملفات عن: سترونتيوم |
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||





