Choroba Charcota-Mariego-Tootha typu 1A
Choroba Charcota-Mariego-Tootha typu 1A, CMT1A, strzałkowy zanik mięśni – choroba z grupy neuropatii dziedzicznych (HMSN, od ang. hereditary motor and sensory neuropathy), o częstości występowania 1:10000. Odpowiada za około 60% wszystkich neuropatii dziedzicznych[1].
Zaliczana jest ona do HMSN typu I z uwagi na swój demielinizacyjny charakter. Charakteryzuje się zwolnieniem przewodzenia w nerwach. Demielinizacja i następcza remielinizacja odpowiada za obecność tzw. struktur cebulowatych (ang. onion bulbs) w badaniu histologicznym.
Dziedziczona jest w sposób autosomalny dominujący. W przeważającej liczbie przypadków jest związana z duplikacją na krótkim ramieniu chromosomu 17 w regionie p11.2-p12, gdzie zlokalizowany jest gen PMP22. PMP22 koduje białko osłonki mielinowej nerwów obwodowych. Możliwe są przypadki mutacji sporadycznych, de novo.
Mężczyźni chorują tak samo często jak kobiety. Przypadki rodzinne stanowią 60% wszystkich CMT1A.
Etiologia[edytuj | edytuj kod]
Genetyczna. Dotyczy genu PMP22 (locus 17p11.2p12), w którym dochodzi do jego duplikacji (duplikacji tandemowej) (98% przypadków) podczas mejotycznego procesu crossing-over. W rezultacie w komórce obecne są 3 kopie genu PMP22. W 2% przypadków dochodzi do mutacji punktowych typu zmiany sensu (niekiedy odpowiedzialne za cięższy przebieg choroby).
Objawy kliniczne i przebieg[edytuj | edytuj kod]
W 75% przypadków pierwsze objawy pojawiają się w pierwszej dekadzie życia, w 10% przypadków w drugiej dekadzie (w wieku kilkunastu lat). Polegają one na zaburzeniach chodu i deformacji stóp (najczęściej stopa nadmiernie wydrążona, jak na zdjęciu poniżej). W badaniu neurologicznym nieobecne są odruchy głębokie kolanowy i skokowy (100% przypadków), występuje niemożność chodzenia na piętach z powodu wczesnego zajęcia mięśnia piszczelowego przedniego (60%), zanik i niedowład odsiebnych mięśni kończyn dolnych (50%), z czasem mięśni kończyn górnych oraz mięśni dosiebnych, powiększenie nerwów (50%). Rzadziej obserwuje się: skrzywienie kręgosłupa, drżenie rąk i ataksję.
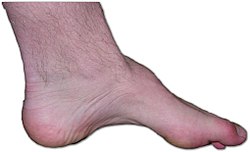
Postęp choroby jest powolny, okresowo ze stabilizacją stanu, na ogół nie prowadzi do ciężkiego inwalidztwa. Stopień ciężkości objawów może się różnić w obrębie nawet jednej rodziny – wśród członków mogą być pacjenci zarówno ze słabo wyrażonymi objawami, jak i z postacią ciężką. Różnica w przebiegu może również dotyczyć bliźniąt jednojajowych[2].
Diagnostyka[edytuj | edytuj kod]
- Badanie neurograficzne wykazuje zwolnienie przewodzenia we włóknach ruchowych nerwu pośrodkowego- 5–34 m/s, średnio kilkanaście m/s, nie przekraczając wartości 20 m/s. Do największego spadku prędkości przewodzenia dochodzi najszybciej w pierwszych latach choroby, z upływem czasu parametry przewodzenia stabilizują się, a postęp objawów wynika raczej ze stopniowym uszkodzeniem aksonalnym. Ponadto obserwuje się: wydłużenie latencji fali F oraz wydłużenie przewodzenia w nerwach krótkich (jak np. n. pachowy, twarzowy). Proces demielinizacji ma charakter uogólniony, dotyczy wszystkich nerwów. Zapis elektromiograficzny (EMG) jest prawidłowy, może jednak czasem być nieznacznie neurogenny, jeśli dojdzie do większego ubytku aksonów.[2]
- Badanie histopatologiczne – do uzyskania materiału do badania przeprowadza się zazwyczaj biopsję nerwu łydkowego. Obraz mikroskopowy odpowiada procesowi demielinizacji i remielinizacji z tworzeniem się struktur cebulowatych. Z czasem pojawiają się zmiany w aksonach, które ulegają zanikowi, powodując ubytek aksonów we włóknach nerwowych. Uważa się, że za atrofię aksonów mogą odpowiadać niejasny jeszcze wpływ białka PMP22 na aksony. Nie ma możliwości odróżnienia postaci z duplikacją PMP22 od postaci z mutacją punktową.[2]
- Badania genetyczne – na świecie dostępne są testy kliniczne oparte na: elektroforezie żelowej w polu pulsacyjnym, FISH, hybrydyzacja Southerna[3].
Leczenie[edytuj | edytuj kod]
Jest podobne jak w pozostałych postaciach neuropatii. Do chwili obecnej nie ma specyficznego leczenia ani terapii genowej, stosowane jest jedynie leczenie objawowe:
- Polegające głównie na fizjoterapii. Ma ona na celu spowolnienie procesu zanikowego mięśni.
- Zastosowanie mają ortezy, utrzymujące kończyny w prawidłowym ułożeniu i zapobiegające ich zniekształceniom.
- Leczenie chirurgiczne zniekształceń kostnych i stawowych.
- Dodatkowo mogą być stosowane okresowo preparaty witaminowe z grupy B i wspomagające przekaźnictwo obwodowe.
- Leczenie eksperymentalne
- selektywny antagonista receptora progesteronu (onapriston). W laboratorium Nave badano możliwość podnoszenia ekspresji mRNA dla genów PMP22 i MPZ w komórkach Schwanna szczurów przez progesteron (komórki Schwanna posiadają na swojej powierzchni receptor dla tego hormonu. Podawanie progesteronu szczurom spowodowało nasilenie się syntezy PMP22 i MPZ w nerwach kulszowych i ich uszkodzenia. Stąd zablokowanie działania progesteronu spowodowało w badaniach obniżenie nadmiernej ekspresji PMP22 i zmniejszało neuropatię u leczonych szczurów.[4]
- kwas askorbinowy. Kwas askorbinowy jest konieczny w procesie mielinizacji hodowanych laboratoryjnie komórek Schwanna i neuronów zwojów grzbietowych. Eksperymentalne podawanie kwasu askorbinowego myszom spowodowało poprawę mielinizacji i redukcję stężenia PMP22 do tak niskich wartości, które nie powodowały objawów klinicznych. Kwas askorbinowy został już zaaprobowany przez amerykańską Agencję Żywności i Leków do stosowania w innych chorobach, co toruje drogę do badań klinicznych w CMT1A[5].
Przypisy[edytuj | edytuj kod]
- ↑ Rowland Levis P.: "Neuropatie obwodowe". W: "Neurologia Merritta". Pod red. H. Kwiecińskiego i A. Kamińskiej. URBAN&PARTNER, Wrocław, 2004, 608. ISBN 83-89581-11-6
- ↑ a b c Kozubski Wojciech: "Choroby i zespoły objawowe obwodowego układu nerwowego". W: Choroby układu nerwowego. Wydawnictwo Lekarskie PZWL, Warszawa, 2004, 287. ISBN 83-200-2636-9
- ↑ Shy ME, "Current Opinion in Neurology" wyd. polskie,2005; 3(1)
- ↑ Sereda MW, Meyer Zu Horste G, Suter U, et al. "Therapeutic administration of progesterone antagonist in a model of Charcot - Marie - Tooth disease (CMT1A". Nat Med 2003;9:1533-1537
- ↑ Passage E, Norreal JC, Noack-Feaissignes P, et al. "Ascorbic acid treatment corrests the phenotype of a mouse model of Charcot - Marie - Tooth disease". Nat Med 2004; 10:396-401
Bibliografia[edytuj | edytuj kod]
- "Choroby i zespoły objawowe obwodowego układu nerwowego". W: Wojciech Kozubski: Choroby układu nerwowego. Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 287.
- "Neuropatie obwodowe". W: Levis P. Rowland: "Neurologia Merritta". pod red. H. Kwiecińskiego i A. Kamińskiej. Wrocław: URBAN&PARTNER, 2004, s. 608.
