Hydroksylaza tyrozynowa
Hydroksylaza tyrozynowa (lub 3-monooksygenaza tyrozyny; EC 1.14.16.2) – enzym z grupy hydroksylaz odpowiedzialny za przekształcenie aminokwasu L-tyrozyny do dihydroksyfenyloalaniny, czyli DOPA.
Funkcja[edytuj | edytuj kod]
Hydroksylaza tyrozynowa, będąca oksygenazą, jest enzymem znajdującym się w cytozolu wszystkich komórek metabolizujących katecholaminy. Przekształca aminokwas tyrozynę w DOPA, aminę katecholową.
Enzym ten jest wysoce specyficzny wobec substratu i nie akceptuje żadnych pochodnych indolu; jest to unikalna cecha hydroksylazy fenyloalaninowej, w porównaniu z innymi enzymami zaangażowanymi w biosyntezę katecholamin, które współpracują z pochodnymi indolu.
Struktura[edytuj | edytuj kod]
Hydroksylaza tyrozynowa jest homotetramerem. Struktura enzymu jest zbliżona do budowy hydroksylazy fenyloalaninowej oraz hydroksylazy tryptofanowej. Każda z czterech podjednostek zawiera po jednym atomie żelaza, którego obecność jest krytyczna dla aktywności enzymatycznej tego enzymu.
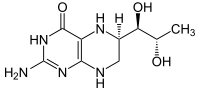
Reakcja[edytuj | edytuj kod]
Medycyna[edytuj | edytuj kod]
Aktywność hydroksylazy tyrozynowej może być spowolniona bądź zatrzymana przez inhibitor α–metylotyrozynę, jednakże nie jest to efektywny środek regulacji biosyntezy amin katecholowych. Środek ten jest rzadko używany, lecz jest bardzo użyteczny w leczeniu guza chromochłonnego. Ma także zastosowanie w przypadkach nadciśnienia tętniczego.