Izotopy wodoru
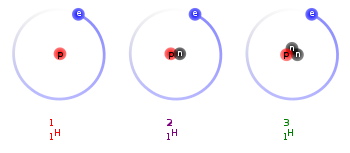
Izotopy wodoru – izotopy pierwiastka chemicznego wodoru (symbol H), z których trzy występują na Ziemi naturalnie. Ze względu na duże względne różnice w masach atomowych najlżejszych izotopów, różnią się one wyraźnie właściwościami chemicznymi i fizycznymi. Z tej przyczyny wodór jest jedynym pierwiastkiem, którego izotopy (naturalne) mają swoje własne nazwy: prot (1H), deuter (2H) i tryt (3H). Prot i deuter są stabilnymi izotopami, tryt i masywniejsze izotopy wodoru są radioaktywne.
Wodór występuje naturalnie na Ziemi jako mieszanina trzech izotopów: 1H (>99,98%), 2H (ok. 0,015%), i 3H (ślady). Średnia masa atomowa tej mieszaniny wynosi 1,00794 u. Pozostałe izotopy wodoru (4H–7H) zostały wytworzone sztucznie[1][2].
Wodór-1 (prot)[edytuj | edytuj kod]
1H stanowi ponad 99,98% wszystkich atomów wodoru. Jego jądro zawiera jedynie proton, a masa atomowa wynosi 1,00782503207(10) u[3]. Opisywane właściwości chemiczne wodoru i jego związków w praktyce odnoszą się zazwyczaj do tego izotopu. Nazwa prot jest obecnie rzadko używana.
Wodór-2 (deuter)[edytuj | edytuj kod]
2H jest drugim stabilnym izotopem wodoru; zawiera proton i neutron w jądrze. Stanowi 0,0026–0,0184% wodoru występującego na Ziemi. Deuter nie jest radioaktywny ani toksyczny. Woda zawierająca atomy deuteru zamiast protu to woda ciężka.
Wodór-3 (tryt)[edytuj | edytuj kod]
3H znany również jako tryt zawiera w jądrze proton i dwa neutrony. Jest radioaktywny, rozpada się w hel-3 poprzez rozpad beta minus z okresem połowicznego rozpadu 12,32 lat[4]. Niewielkie ilości trytu występują na Ziemi z powodu oddziaływania promieniowania kosmicznego z gazami atmosferycznymi; tryt jest także produktem reakcji nuklearnych.
Wodór-4[edytuj | edytuj kod]
4H jest wysoko niestabilnym izotopem wodoru. Jądro składa się z protonu i trzech neutronów. Został sztucznie wytworzony w laboratorium w wyniku bombardowania trytu rozpędzonymi do dużej prędkości jądrami deuteru[5]. Obecność wodoru-4 została stwierdzona przez wykrycie emitowanych protonów. Jego masa atomowa wynosi 4,02781±0,00011 u[3]. Ulega rozpadowi poprzez emisję neutronu i ma okres połowicznego rozpadu (1,39±0,10)×10−22 sekundy[6].
Wodór-5[edytuj | edytuj kod]
5H jest kolejnym wysoko niestabilnym izotopem wodoru. Jądro składa się z protonu i czterech neutronów. Został uzyskany razem z wodorem-4 podczas bombardowania trytu rozpędzonymi jądrami trytu[5][7]. Ulega rozpadowi poprzez podwójną emisję neutronu, a okres jego połowicznego rozpadu co najmniej 9,1×10−22 sekundy[6].
Wodór-6[edytuj | edytuj kod]
6H ulega potrójnej emisji neutronów, okres połowicznego rozpadu 3×10−22 sekundy. Składa się z protonu i pięciu neutronów.
Wodór-7[edytuj | edytuj kod]
7H składa się z protonu i sześciu neutronów. Został otrzymany po raz pierwszy w 2003 roku przez grupę rosyjskich, japońskich i francuskich fizyków w wyniku bombardowania tarczy z zestalonego wodoru wysokoenergetycznymi atomami 8He[2][8].
| symbol nuklidu |
Z (p) | N (n) | masa izotopu (u)[3] |
czas półtrwania[6] | tryb rozpadu[9] |
izotopy potomne[ii][9] |
spin jądrowy[6] | typowy udział izotopu w wodzie (ułamek molowy) |
zakres naturalnego zróżnicowania (ułamek molowy) |
|---|---|---|---|---|---|---|---|---|---|
| 1H | 1 | 0 | 1,00782503207(10) | stabilny[iii] | ½+ | 0,999885(70) | 0,999816–0,999974 | ||
| 2H | 1 | 1 | 2,01410177785(36) | stabilny | 1+ | 0,000115(70) | 0,000026–0,000184 | ||
| 3H | 1 | 2 | 3,0160492777(25) | 12,32(2) a | β− | 3He | ½+ | ślady[iv] | |
| 4H | 1 | 3 | 4,02781(11) | 1,39(10)×10−22 s [4,6(9) MeV] |
n | 3H | 2− | ||
| 5H | 1 | 4 | 5,03531(11) | >9,1×10−22 s (?) | n | 4H | (½+) | ||
| 6H | 1 | 5 | 6,04494(28) | 2,90(70)×10−22 s [1,6(4) MeV] |
3n | 3H | 2−[v] | ||
| 4n | 2H | ||||||||
| 7H | 1 | 6 | 7,05275(108)[v] | 2,3(6)×10−23 s[v] [20(5) MeV][v] |
½+[v] | ||||
| |||||||||
Przypisy[edytuj | edytuj kod]
- ↑ Y.B. Gurov, D.V. Aleshkin, M.N. Berh, S.V. Lapushkin i inni. Spectroscopy of superheavy hydrogen isotopes in stopped-pion absorption by nuclei. „Physics of Atomic Nuclei”. 68 (3), s. 491–497, 2004.
- ↑ a b A.A. Korsheninnikov, E. Yu. Nikolskii, E.A. Kuzmin, A. Ozawa i inni. Experimental Evidence for the Existence of 7H and for a Specific Structure of 8He. „Physical Review Letters”. 90, s. 082501, 2003. DOI: 10.1103/PhysRevLett.90.082501.
- ↑ a b c The 2003 Atomic Mass Evaluation. Atomic Mass Data Center. [dostęp 2008-11-15].
- ↑ Gary L. Miessler, Donald Arthur Tarr: Inorganic Chemistry. Wyd. 3. Upper Saddle River, New Jersey: Pearson Education, 2004. ISBN 978-0-13-035471-6.
- ↑ a b G.M. Ter-Akopian, Yu. Ts. Oganessian, D.D. Bogdanov, A.S. Fomichev i inni. Hydrogen-4 and Hydrogen-5 from t+t and t+d transfer reactions studied with a 57.5-MeV triton beam. „AIP Conference Proceedings”. 610, s. 920–924, 2002. DOI: 10.1063/1.1470062.
- ↑ a b c d G. Audi, O. Bersillon, J. Blachot, A.H. Wapstra. The NUBASE evaluation of nuclear and decay properties. „Nuclear Physics A”. 729, s. 3–128, 2003. DOI: 10.1016/j.nuclphysa.2003.11.001.
- ↑ A.A. Korsheninnikov, M.S. Golovkov, I. Tanihata, A.M. Rodin i inni. Superheavy Hydrogen 5H. „Physical Review Letters”, s. 92501, 2001. DOI: 10.1103/PhysRevLett.87.092501.
- ↑ Belle Dumé: Hydrogen-7 makes its debut. Institute of Physics, 2003-03-07. [dostęp 2012-02-08]. [zarchiwizowane z tego adresu (2010-01-16)]. (ang.).
- ↑ a b Universal Nuclide Chart. Nucleonica.
Bibliografia[edytuj | edytuj kod]
- Składy izotopowe za: Atomic weights of the elements. Review 2000 (IUPAC Technical Report). „Pure Appl. Chem.”. 75 (6), s. 683–800, 2003. oraz Standard Atomic Weights Revised. Międzynarodowa Unia Chemii Czystej i Stosowanej. [dostęp 2011-02-05]. [zarchiwizowane z tego adresu (2008-03-05)]. (ang.).
- Niektóre informacje o izotopach pochodzą z następujących źródeł:
- NuDat 2.5. National Nuclear Data Center, Brookhaven National Laboratory. [dostęp 2011-02-05]. (ang.).
- Norman E. Holden in: Table of the Isotopes. W: CRC Handbook of Chemistry and Physics. David R. Lide (red.). Wyd. 85. Boca Raton, Floryda: CRC Press, 2005.
