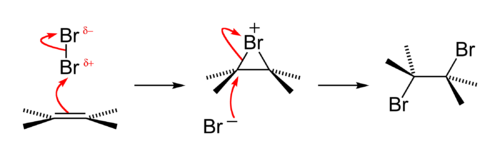Halogenowanie: Różnice pomiędzy wersjami
| [wersja przejrzana] | [wersja przejrzana] |
m r2.7.3) (Robot dodał tr:Halojenleme |
|||
| Linia 50: | Linia 50: | ||
[[Kategoria:Reakcje chemiczne]] |
[[Kategoria:Reakcje chemiczne]] |
||
[[ar:هلجنة]] |
|||
[[ca:Halogenació]] |
|||
[[cs:Halogenace]] |
|||
[[de:Halogenierung]] |
|||
[[et:Halogeenimine]] |
|||
[[en:Halogenation]] |
|||
[[es:Halogenación]] |
|||
[[fr:Halogénation]] |
|||
[[hr:Halogeniranje]] |
|||
[[it:Alogenazione]] |
|||
[[he:הלוגנציה]] |
|||
[[lv:Halogenēšana]] |
|||
[[nl:Halogenering]] |
|||
[[no:Halogenering]] |
|||
[[pt:Halogenação]] |
|||
[[sk:Halogenácia]] |
|||
[[sl:Kloriranje]] |
|||
[[fi:Halogenointi]] |
|||
[[sv:Halogenering]] |
|||
[[tr:Halojenleme]] |
|||
[[zh:卤化]] |
|||
Wersja z 20:01, 12 mar 2013
Halogenowanie – reakcja chemiczna polegająca na addycji (dodaniu), substytucji (podstawieniu) lub przegrupowaniu atomów pierwiastków z grupy fluorowców (halogenów) do cząsteczek dowolnych związków chemicznych[1].
Przykłady halogenowania
Chlorowanie metanu
Chlorowanie metanu jest przykładem reakcji halogenowania stosunkowo mało reaktywnych nasyconych węglowodorów alifatycznych. Jednak w pewnych warunkach (promieniowanie świetlne, ogrzewanie, obecność nadtlenków) zachodzi reakcja chlorowania według mechanizmu wolnorodnikowego.
Przebieg reakcji:
- Inicjowanie: w pierwszym etapie chlor, najczęściej pod wpływem promieniowania UV, ulega rozpadowi na wolne rodniki, inicjujące łańcuch reakcji.
- Cl2 → Cl· + Cl·
- Propagacja: wolne rodniki chloru reagują z metanem, tworząc rodnik metylowy, który następnie w reakcji z wolnym chlorem tworzy produkt (jeden z wielu) chlorowania i kolejny wolny rodnik zdolny do dalszych reakcji:
- CH4 + Cl· → CH3· + HCl
- CH3· + Cl2 → CH3Cl + Cl·
- CH3Cl + Cl· → CH2Cl· + HCl
- CH2Cl· + Cl2 → CH2Cl2 + Cl·
- itd..
- Chlorowanie przebiega do mono- i wielopodstawionych chloropochodnych metanu CH3Cl, CH2Cl2, CHCl3 oraz CCl4.
- Zakończenie łańcucha reakcji – może zajść na wiele sposobów. Najczęściej jest to spowodowane rekombinacją się dwóch wolnych rodników, która prowadzi do powstania niereaktywnych cząsteczek:
- CH3· + Cl· → CH3Cl
Bromowanie etenu
Bromowanie etenu bromem jest przykładem reakcji halogenowania alkenów, która przebiega zgodnie z mechanizmem addycji elektrofilowej.
Przebieg reakcji:
Elektrony wiązania π etenu atakują cząsteczkę bromu. Powstaje kompleks π. Wiązanie pomiędzy atomami bromu ulega polaryzacji i pęka tworząc jon bromoniowy i bromkowy:
Jon bromkowy (Br-) atakuje karbokation od drugiej strony niż przyłączony w pierwszej kolejności atom halogenu tworząc dibromopochodną etanu w konformacji s-trans (w konfromacji antiperiplanarnej)
Chlorowanie benzenu
Benzen ulega reakcji chlorowania pod wpływem światła. Produktem jest heksachlorocykloheksan (HCH), którego jeden izomer przestrzenny, zwany lindanem ma właściwości owadobójcze
W przypadku obecności w środowisku reakcji katalizatora o własnościach silnego kwasu Lewisa (AlCl3, FeCl3, czy SnCl) zachodzi substytucja elektrofilowa, która zachodzi zgodnie z mechanizmem Friedla-Craftsa. Rolą katalizatora jest wytworzenie dodatniego czynnika elektrofilowego Cl+:
- AlCl3 + Cl2 → AlCl4- + Cl+

W przypadku związków aromatycznych z bocznym łańcuchem alkilowym (np. toluen) podczas reakcji w obecności katalizatora (AlCl3) następuje podstawienie pierścienia aromatycznego w pozycje orto- i para-. Gdy zaś reakcję prowadzi się w warunkach sprzyjającym tworzeniu wolnych rodników (światło, nadtlenki) atom halogenu ulega podstawieniu w łańcuchu bocznym.
- ↑ Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 158, ISBN 83-7183-240-0.