Halogenowodorowanie
Halogenowodorowanie – reakcja chemiczna addycji halogenowodorów (HI, HCl lub HBr) do nienasyconych związków organicznych.
W przypadku addycji halogenowodorów do wiązań wielokrotnych węgiel-węgiel reakcja ta ma zazwyczaj dwuetapowy, jonowy mechanizm i zachodzi zgodnie z regułą Markownikowa. Reakcje przeprowadza się zwykle w warunkach bezwodnych, np. przepuszczając gazowy halogenowodór przez związek organiczny[1].
Przykłady[edytuj | edytuj kod]
Bromowodorowanie propenu[edytuj | edytuj kod]
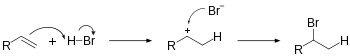
3). Produktem pośrednim jest karbokation II-rzędowy z ładunkiem na atomie C2
Elektrony wiązania π cząsteczki propenu atakują bromowodór, tworząc wiązanie σ C−H, w którym uczestniczą oba elektrony tworzące wcześniej wiązanie π. Na skutek tego jeden z atomów węgla przy podwójnym wiązaniu uzyskuje ładunek dodatni i powstaje karbokation, czemu towarzyszy powstanie anionu bromkowego Br−
. Ładunek dodatni w karbokationie zlokalizowany jest na atomie węgla o wyższej rzędowości, tj. II-rzędowym atomie C2, a nie I-rzędowym atomie C1, co wynika z większej trwałości karbokationów o wyższej rzędowości. Karbokation ten przyłącza anion bromkowy tworząc ostatecznie 2-bromopropan, zgodnie z regułą Markownikowa. Alternatywny produkt, 1-bromopropan nie powstaje[2]:
- CH
2=CH−CH
3 + HBr → CH
3−C+
H−CH
3 + Br−
→ CH
3−CHBr−CH
3
Regioselektywność bropmowodorowania można odwrócić na niezgodne z regułą Markownikowa tworzenie 1-bromopropanu poprzez prowadzenie reakcji w obecności nadtlenków[3].
Chlorowodorowanie propynu[edytuj | edytuj kod]
Podobnie jak w poprzednim przykładzie, reakcja zaczyna się od ataku elektronów jednego z dwóch wiązań π cząsteczki propynu, w wyniku czego powstaje wiązanie C−H i II-rzędowy karbokation winylowy (CH
3C+
H=CH
2), do którego przyłącza się anion chlorkowy Cl−
. Produktem tej reakcji, zgodnej z regułą Markownikowa, jest 2-chloropropen, który zawiera wciąż jedno wiązanie wielokrotne węgiel-węgiel; co powoduje, że może on w drugim etapie przyłączyć kolejną cząsteczkę chlorowodoru[4]. Dobierając jednak odpowiednio warunki reakcji, można ją zatrzymać na tym etapie. Ułatwia to fakt, że addycja do chloroalkenu jest wolniejsza niż do alkinu[5][6]:
- CH
3CH≡CH + HCl → CH
3C+
H=CH
2 + Cl−
→ CH
3−CCl=CH
2
W drugim etapie jedyne wiązanie π 2-chloropropenu atakuje kolejną cząsteczkę chlorowodoru, na skutek czego tworzy się kolejne wiązanie C−H i karbokation, z ładunkiem dodatnim ponownie na atomie węgla C2. Następnie do powstałego karbokationu przyłącza się anion chlorkowy i zgodnie z regułą Markownikowa powstaje 2,2-dichloropropan[5][4]:
- CH
3−CCl=CH
2 + HCl → CH
3−C+
HCl−CH
3 + Cl−
→ CH
3−CHCl
2−CH
3
Karbokationy winylowe tworzą się trudniej niż alkilowe. Powstanie II-rzędowego (jak w powyższym przykładzie) karbokationu winylowego wymaga podobnych warunkó, jak utworzenie I-rzędowego karbokationu alkilowego (I-rzędowe karbokationy winylowe, np. +
CH=CH
2, w ogóle nie są znane). Z tego powodu halogenowodorowanie alkinów może przebiegać wg innych, bardziej skomplikowanych mechanizmów[4].
Przypisy[edytuj | edytuj kod]
- ↑ Morrison i Boyd 1985 ↓, Addycja halogenowodoru. Reguła Markownikowa, s. 233–236.
- ↑ Morrison i Boyd 1985 ↓, Addycja elektrofilowa. Orientacja i reaktywność, s. 241–245.
- ↑ Morrison i Boyd 1985 ↓, Addycja bromowodoru. Efekt nadtlenkowy, s. 236–237.
- ↑ a b c Reactions of Alkynes: Addition of HX and X2, [w:] John McMurry, Organic Chemistry, wyd. 10, OpenStax, s. 289–291 [dostęp 2023-11-27] (ang.).
- ↑ a b Morrison i Boyd 1985 ↓, Reakcje alkinów, s. 310–312.
- ↑ Morrison i Boyd 1985 ↓, Reakcje addycji alkinów, s. 312.
Bibliografia[edytuj | edytuj kod]
- Robert T. Morrison, Robert N. Boyd, Chemia organiczna, t. 1, Warszawa: PWN, 1985, ISBN 83-01-04166-8.
