Disiarczek żelaza(II)
| |||||||||
 Kryształy pirytu | |||||||||
| |||||||||
| Ogólne informacje | |||||||||
| Wzór sumaryczny |
FeS2 | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
119,97 g/mol | ||||||||
| Minerały | |||||||||
| Identyfikacja | |||||||||
| Numer CAS | |||||||||
| PubChem | |||||||||
Disiarczek żelaza(II), FeS
2 – nieorganiczny związek chemiczny z grupy wielosiarczków, zawierający żelazo na II stopniu utlenienia[2]. Anionem jest disiarczek, S2−
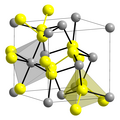
2, w którym atomy siarki połączone są wiązaniem pojedynczym. Występuje naturalnie jako piryt, markazyt i in.[1] Struktura pirytu przypomina chlorek sodu, NaCl, gdzie atomy żelaza zajmują miejsca atomów sodu, a grupy S
2 miejsca atomów chloru, przy czym układ S−S nie jest równoległy do żadnej osi komórki elementarnej[3][4]. Struktura markazytu jest podobna, ale mniej regularna[3] i bywa określana jako wariant rutylu (TiO
2)[4]. Piryt jest jednym z najpowszechniej występujących minerałów siarki i jest najważniejszym źródłem siarki w przemyśle[5].
Można go otrzymać np. przez ogrzewanie Fe
2O
3 z H
2S[6] lub FeS z H
2S lub z siarką[7]:
- 8FeS + S
8 → FeS
2 - FeS + H
2Saq → FeS
2 + H
2↑
Jest związkiem bardzo trwałym w normalnych temperaturach[6]. Podczas prażenia na powietrzu rozkłada się z wydzieleniem dwutlenku siarki, SO
2[6][8]:
- 4FeS
2 + 11O
2 → 2Fe
2O
3 + 8SO
2↑,
który jest wykorzystywany do produkcji kwasu siarkowego[8].
Natomiast jeżeli prażenie odbywa się bez dostępu powietrza, siarka w FeS
2 ulega dysproporcjonowaniu[6][9]:
- 2FeS
2 → 2FeS + S
2↑
Przypisy
[edytuj | edytuj kod]- ↑ a b Greenwood i Earnshaw 1997 ↓, s. 555.
- ↑ pyrite, [w:] John Daintith, A Dictionary of Chemistry, wyd. 6, New York: Oxford University Press, 2008, s. 445, ISBN 978-0-19-920463-2.
- ↑ a b F. Albert Cotton, Geoffrey Wilkinson, Advanced inorganic chemistry, wyd. 4, New York: Wiley, 1980, s. 514, ISBN 978-0-471-02775-1.
- ↑ a b Greenwood i Earnshaw 1997 ↓, s. 680.
- ↑ Greenwood i Earnshaw 1997 ↓, s. 647–649, 698.
- ↑ a b c d Greenwood i Earnshaw 1997 ↓, s. 1081.
- ↑ Arnold F. Holleman, Egon Wiberg, Nils Wiberg, Anorganische Chemie. Band 2: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide, wyd. 103, Berlin: De Gruyter, 2017, s. 1961, DOI: 10.1515/9783110495904, ISBN 978-3-11-049590-4 (niem.).
- ↑ a b Adam Bielański, Podstawy chemii nieorganicznej, wyd. 5, Warszawa: PWN, 2002, s. 931, ISBN 83-01-13654-5.
- ↑ Nivaldo J. Tro, Chemistry. A molecular approach, wyd. 3, Boston, Mass.: Pearson, 2014, s. 1060, ISBN 978-0-321-80924-7.
Bibliografia
[edytuj | edytuj kod]- Norman N. Greenwood, Alan Earnshaw, Chemistry of the Elements, wyd. 2, Oxford–Boston: Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 (ang.).