Cykl Calvina: Różnice pomiędzy wersjami
| [wersja przejrzana] | [wersja przejrzana] |
m →Historia badań: , drobne merytoryczne |
m →Historia badań: cdn... |
||
| Linia 42: | Linia 42: | ||
== Historia badań == |
== Historia badań == |
||
Badania mechanizmów fotosyntetycznej asymilacji CO<sub>2</sub> rozpoczął [[Samuel Ruben]] w roku 1939, stosując początkowo izotop węgla <sup>11</sup>C<ref>{{cytuj pismo|autor=Ruben S. , Kamen M. D. , Hassid W. Z. , Devault D. C. |tytuł=PHOTOSYNTHESIS WITH RADIO-CARBON|czasopismo=Science|wydanie=2346|numer=90|strony=570 - 571|data=1939|doi=10.1126/science.90.2346.570}}</ref>. Badania ułatwiło odkrycie wraz z [[Martin Karmen|Martinem Kamenem]] izotopu węgla <sup>14</sup>C<ref>{{cytuj pismo|autor=Ruben S., Kamen M. D.|tytuł=Long-Lived Radioactive Carbon: C14|czasopismo=Physical Review|wydanie=4|numer=59|strony=349-354|data=1941|doi=10.1103/PhysRev.59.349}}</ref>. Jednak nagła śmierć Samuela Rubena spowodowała przerwanie badań w roku 1943. Zostały one wznowione w roku 1945 przez [[Earnest O. Lawrence|Earnesta O. Lawrenca]]. |
Badania mechanizmów fotosyntetycznej asymilacji CO<sub>2</sub> rozpoczął [[Samuel Ruben]] w roku 1939, stosując początkowo izotop węgla <sup>11</sup>C<ref>{{cytuj pismo|autor=Ruben S. , Kamen M. D. , Hassid W. Z. , Devault D. C. |tytuł=PHOTOSYNTHESIS WITH RADIO-CARBON|czasopismo=Science|wydanie=2346|numer=90|strony=570 - 571|data=1939|doi=10.1126/science.90.2346.570}}</ref><ref>{{Cytuj pismo | autor=Pennazio S | tytuł=Photosynthesis: a short history of some modern experimental approaches. | rok= | czasopismo=Rivista di biologia | doi= | wydanie=96 | numer=1 | miesiąc= | pmid= 12852175 | strony=73–86}}</ref>. Badania ułatwiło odkrycie wraz z [[Martin Karmen|Martinem Kamenem]] izotopu węgla <sup>14</sup>C<ref>{{cytuj pismo|autor=Ruben S., Kamen M. D.|tytuł=Long-Lived Radioactive Carbon: C14|czasopismo=Physical Review|wydanie=4|numer=59|strony=349-354|data=1941|doi=10.1103/PhysRev.59.349}}</ref>. Jednak nagła śmierć Samuela Rubena spowodowała przerwanie badań w roku 1943. Zostały one wznowione w roku 1945 przez [[Earnest O. Lawrence|Earnesta O. Lawrenca]] kierującego University of California Radiation Laboratory, który powierzył [[Melvin Calvin|Melvinowi Calvinowi]] stworzenie grupy zajmującej się badaniami chemicznymi i biochemicznymi przy użyciu radioizotopów. Do kierowania podgrupą badającą fotosyntezę został wyznaczony [[Andrew Benson]]<ref>{{Cytuj pismo | autor=Benson AA | tytuł=Following the path of carbon in photosynthesis: a personal story. | rok=2002 | czasopismo=Photosynthesis research | doi=10.1023/A:1020427619771 | wydanie=73 | numer=1-3 | miesiąc= | pmid= 16245101 | strony=29–49}}</ref>. Po zakończeniu II wojny światowej do grupy badającej przebieg fotosyntezy dołączył [[James A. Bassham]]<ref>{{Cytuj pismo | autor=Bassham JA | tytuł=Mapping the carbon reduction cycle: a personal retrospective. | rok=2003 | czasopismo=Photosynthesis research | doi=10.1023/A:1024929725022 | wydanie=76 | numer=1-3 | miesiąc= | pmid= 16228564 | strony=35–52}}</ref>. |
||
== Zobacz też == |
== Zobacz też == |
||
Wersja z 19:45, 2 kwi 2009
|
|
Przeprowadzana jest gruntowna przebudowa tego artykułu. Aby zapobiec konfliktom edycji prosimy nie edytować strony do czasu usunięcia tej wiadomości. Wikipedysta Pisum (dyskusja, wkład) Jeżeli ten artykuł nie był edytowany od kilku (nie dotyczy komunikatu o „gruntownej przebudowie”) godzin, należy usunąć szablon. |

Cykl Calvina-Bensona-Basshama (CBB), Cykl Calvina-Bensona, cykl Calvina, redukcyjny cykl węgla, cykl PCR (PCR – ang. Photosynthetic Carbon Reduction), redukcyjny szlak pentozofosforanowy – cykl biochemiczny który zachodzi w stromie chloroplastów oraz cytoplazmie niektórych bakterii, jest to drugi etap fotosyntezy określany jako faza bezpośrednio niezależna od światła lub faza ciemna fotosyntezy. W cyklu Calvina zostają zużyte produkty reakcji świetlnych fotosyntezy, ATP i NADPH, określane jako siła asymilacyjna, jednocześnie z dwutlenku węgla zostają wytworzone cukry proste w postaci heksoz. Sumaryczne równanie reakcji zachodzących w cyklu Calvina jest następujące:
6CO2 + 18ATP + 12 NADPH + 12H2O → C6H12O6 + 18ADP+ 18Pi + 12NADP+ + 6 H+
W cyklu Calvina-Bensona wyróżnia się trzy fazy:
- Faza karboksylacyjna, w której CO2 wiązany jest do rybulozo-1,5-bisfosforanu. W efekcie powstają dwie cząsteczki 3-fosfoglicerynianu
- Faza redukcyjna, w której 3-fosfoglicerynian ulega przekształceniu do aldehydu 3-fosfoglicerynowego. Związek ten może zostać przekształcony do heksoz.
- Faza regeneracyjna, w której z cząsteczek aldehydu 3-fosfoglicerunowego zostaje odtworzony akceptor CO2 – rybulozo-1,5-bisfosforan.
Cykl został odkryty przez Melvina Calvina i Andrew Bensona z Uniwersytetu Kalifornijskiego w Berkeley, znaczący wkład miał również James Bassham. Za prace nad cyklem Melvin Calvin otrzymał Nagrodę Nobla w dziedzinie chemii w roku 1961.
Przebieg
Faza karboksylacyjna (karboksylacji)
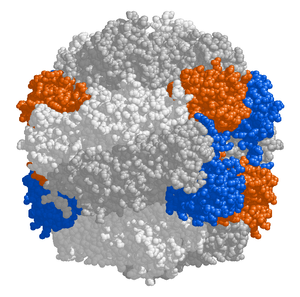
Rozpoczyna się od przyłączenia cząsteczki CO2 do 1,5-bisfosforybulozy (RuBP). Reakcja ta katalizowana jest przez enzym o nazwie karboksylaza 1,5-bisfosforybulozy, często określanym jako enzym RuBisCO (ang. ribulose bisphosphate carboxylase-oxygenase) lub karboksydysmutaza[1]. Enzym ten działa stosunkowo wolno, liczba obrotów wynosi zaledwie 3 s-1. Aby zapewnić odpowiednio szybki przebieg reakcji karboksylacji organizmy fotosyntetyzujące wytwarzają znaczne ilości RuBisCO, enzym stanowi 15-50% białek rozpuszczalnych w liściu i jest prawdopodobnie najbardziej rozpowszechnionym białkiem w biosferze[2]. Karboksylaza RuBP obecna w chloroplastach składa się z 16 podjednostek, ośmiu małych (S) o masie 14 kDa i ośmiu dużych (L) o masie 55 kDa[3]. Centrum aktywne oraz miejsca regulatorowe znajdują się na podjednostce dużej[4], podjednostki małe zwiększają aktywność enzymu[5]. RuBisCO ulega aktywacji poprzez przyłączenie cząsteczki CO2 w miejscu regulatorowym. Cząsteczka ta nie bierze udziału w reakcji a jedynie wpływa na aktywność enzymu tworząc karbominian z grupą ε-aminową lizyny 201[6]. Utworzenie karbominianu katalizowane jest przez aktywazę RuBisCO[7]. Do przeprowadzenie reakcji karboksylacji konieczne jest również przyłączenie do enzymu jonu Mg2+[8], jon ten uczestniczy w umożliwia przyłączenie grupy ketonowej i położonej obok niej grupy hydroksylowej rybulozo-1,5-bisfosforanu. Związek ten po przyłączeniu do enzymu traci protony, a endiolowy produkt pośredni łączy się z cząsteczką CO2. W wyniku przyłączenia CO2 powstaje nietrwały produkt przejściowy 2-karboksy-3-keto-D-arabinitolo-1,5-bisfosforan. Ten β-kwas ulega uwodnieniu, a następnie rozpada się na dwie cząsteczki kwasu 3-fosfoglicerynowego (PGA)[9].
Faza redukcyjna (redukcji)
Faza redukcji składa się z dwóch reakcji w wyniku których zostaje wytworzony prosty cukier – fosfotrioza – aldehyd 3-fosfoglicerynowy. Powstały w fazie karboksylacyjnej 3-fosfoglicerynian (PGA) przy udziale ATP ulega fosforylacji do 1,3-bisfosfoglicerynianu. Reakcję katalizuje kinaza fosfoglicerynowa. Produkt reakcji jest następnie redukowany, przy zużyciu NADPH, do aldehydu 3-fosfoglicerynowego (PGAL) przez dehydrogenazę aldehydu 3-fosfoglicerynowego. Część powstałego aldehydu 3-fosfoglicerynowego przekształcana jest przez izomerazę fosfotriozową do fosfodihydroksyacetonu (DHAP). Oba, PGAL i DHAP, ulegają kondensacji w reakcji katalizowanej przez aldolazę. W efekcie zostaje wytworzona heksoza – 1,6-bisfosfofruktoza. Może ona być łatwo przekształcona w glukozę. Większość powstałych w fazie redukcji fosfotrioz nie jest przekształcana w glukozę lecz przechodzi do kolejnego etapu cyklu Calvina[10].
Faza regeneracyjna (regeneracji)
W tej fazie z aldehydu 3-fosfoglicerynowego i jego izomeru fosfodihydroksyacetonu odtwarzana jest w wyniku wielu reakcji chemicznych 1,5-bisfosforybuloza. Kluczowymi enzymami biorącymi udział w przekształcaniu węglowodanów są aldolaza i trasketolaza[11]. Aldolaza katalizuje reakcję kondensacji aldolowej fosfodihydroksyacetonu z aldehydem. Po połączeniu obu cząsteczek powstaje fruktozo-1,6-bisfosforan. Po odłączeniu jednej z reszt fosforanowych powstaje fruktozo-6-fosforan[12]. Związek ten łatwo może zostać przekształcony w glukozo-6-fosforan lub glukozo-1-fosforan i posłużyć do syntezy skrobi. Jednak aby cykl Calvina mógł zachodzić konieczne jest wykorzystanie cześć fruktozo-6-fosforanu do odtworzenia rybulozo-1,5-bisfosforanu. Transketolaza jest enzymem zdolnym do przeniesienie jednostki dwuwęglowej z ketozy na aldozę. Jednostka ta jest pobierana z fruktozo-6-fosforanu i przyłączana do cząsteczki aldehydu 3-fosfoglicerynowego. W efekcie odłączenie jednostki dwuwęglowej powstaje erytrozo-4-fosforan, a z aldehydu powstaje pięciowęgolwy cukier – ksylulozo-5-fosforan. Związek ten przekształcany jest do rybulozo-5-fosforanu przez epimerazę fosfopentozową. Erytrozo-4-fosforan zostaje połączona z fosfodihydroksyacetonem w kolejnej reakcji katalizowanej przez aldolazę. Produktem reakcji jest cukier siedmioęglowy – sedoheptulozo-1,7-bisfosforan. Jest on dawcą kolejnej jednostki dwuwęglowej przenoszonej przez transketolazę na aldehyd 3-fosfoglicerynowy. Jednak przed przeniesieniem od sedoheptulozo-1,7-bisfosforanu odłączana jest reszta fosforanowa w pozycji 1[13]. Reakcję hydrolizy katalizuje fosfataza sedoheptulozo-1,7-bisfosforanowa. Produktami reakcji katalizowanej przez transketolazę są dwa cukry pięciowęglowe, rybozo-5-fosforan będący pozostałością siedmiowęglowego węglowodanu i ksylulozo-5-fosforan. Ten ostatni przekształcany jest przez izomerazę fosfopentozową do rybulozo-5-fosforanu. Ostatecznym produktem wymienionych reakcji jest więc zawsze pięciowęgolwy rybulozo-5-fosforan. W celu odtworzenia związku będącego akceptorem CO2 cukier zostaje ufosforylowany w pozycji 1 przez kinazę fosforybulozy. Podczas fosforylacji zostaje zużyta cząsteczka ATP, a produktem jest pierwszy związek cyklu – rybulozo-1,5-bisfosforan[10].
Pierwszy z kluczowych enzymów, aldolaza, przenosi jednostki trójwęglowe fosforanu dihydroksyacetonu dzięki wiązaniu grupy karbonylowej ketozy do ε-aminowej reszty lizyny, w centrum aktywnym enzymu. Połączenie z grupą aminową ma charakter zasady Schiffa. Do związanej ketozy przyłączany jest substrat aldozowy.
Reakcje katalizowane przez aldolazę i transketolazę są reakcjami odwracalnymi i mogą być wykorzystane w rozkładzie heksoz, co ma miejsce w cytozolu gdzie zachodzi szereg reakcji odwrotnych w stosunku do fazy regeneracji nazywanych szlakiem pentozofosforanowym[14].
W wyniku cyklu Calvina-Bensona zużywane są wytworzone w fazie jasnej ATP i NADPH, a ich energia magazynowana jest w postaci wiązań wytwarzanych w cyklu cukrów[10].
Regulacja cyklu Calvina
Zachodzenie cyklu umożliwiającego wytworzenie związków organicznych z CO2. W celu precyzyjnej koordynacji fazy świetlnej z reakcjami cyklu Calvina organizmy fotosyntetyzujące posiadają mechanizmy kontrolne. Enzymy cyklu są aktywowane w wyniku wzrostu pH stromy wzrostu stężenia jonów Mg2+, NADPH oraz zredukowanej ferredoksyny[15].
Zmiany stężenia jonów
W wyniku zachodzenia fazy świetlnej fotosyntezy jony wodorowe ze stromy przenoszone są do wnętrza tylakoidów. Obniżenie pH stromy chloroplastów ułatwia powstawanie karbaminianu, który przyłączany jest do RuBisCO powodując aktywację enzymu[16]. Przenoszenie protonów przez błony tylakoidów wiąże się z powstawaniem różnicy potencjałów w poprzek błony. Jest ona częściowo kompensowana przez przepływ jonów Mg2+ z wnętrza tylakoidów do stromy. Jony magnezu są drugim składnikiem niezbędnym do przeprowadzenia reakcji przez karboksylazę RuBP[17][18].
Tioredoksyna
Tioredoksyna to niewielkie białko o masie 12 kDa obecne w stromie chloroplastów[19]. Białko zawiera sąsiadujące ze sobą reszty cysteiny, które mogą znajdować się w formie utlenionej tworząc mostek dwusiarczkowy lub w formie zredukowanej, tiolowe[20]. Chociaż sama tioredoksyna nie jest enzymem cyklu Calvina może ona służyć jako reduktor dla enzymów cyklu[21]. Jedynie zredukowane formy enzymów wykazują aktywność. Aktywacja, następuje na świetle, na skutek przeniesienia elektronów z ferredoksyny na tioredoksynę w reakcji katalizowanej przez reduktazę ferredoksyna-tioredoksyna co prowadzi do zerwania mostku dwusiarczkowego, i następnie na enzymy katalizujące reakcje asymilacji CO2[22].
Tworzenie kompleksów enzymów
W ciemności enzymy cyklu ulegają dezaktywacji. Odbywa się to poprzez połączenie kinazy fosforybulozy i dehydrogenazy aldehydu 3-fosfoglicerynowego za pośrednictwem niewielkiego białka o nazwie CP12[23]. Kompleks złożony z dwóch enzymów i białka CP12 nie wykazuje aktywności[24]. Rozpad kompleksu następuje po zredukowaniu kinazy fosforybulozy przez tioredoksynę i przyłączenie do nieaktywnego kompleksy NADPH. Do rozdzielenie enzymów dochodzi na świetle gdy stężenie NADPH w stromie wzrasta na skutek zachodzenia reakcji fazy świetlnej[25].
Historia badań
Badania mechanizmów fotosyntetycznej asymilacji CO2 rozpoczął Samuel Ruben w roku 1939, stosując początkowo izotop węgla 11C[26][27]. Badania ułatwiło odkrycie wraz z Martinem Kamenem izotopu węgla 14C[28]. Jednak nagła śmierć Samuela Rubena spowodowała przerwanie badań w roku 1943. Zostały one wznowione w roku 1945 przez Earnesta O. Lawrenca kierującego University of California Radiation Laboratory, który powierzył Melvinowi Calvinowi stworzenie grupy zajmującej się badaniami chemicznymi i biochemicznymi przy użyciu radioizotopów. Do kierowania podgrupą badającą fotosyntezę został wyznaczony Andrew Benson[29]. Po zakończeniu II wojny światowej do grupy badającej przebieg fotosyntezy dołączył James A. Bassham[30].
Zobacz też
- ↑ Tabita F. R.. Microbial ribulose 1,5-bisphosphate carboxylase/oxygenase: A different perspective. „Photosynthesis Research”, s. 1-28, 1999.
- ↑ Simova-Stoilova L., Stoyanova Z. , Demirevska-Kepova K.. ONTOGENIC CHANGES IN LEAF PIGMENTS, TOTAL SOLUBLE PROTEIN AND RUBISCO IN TWO BARLEY VARIETIES IN RELATION TO YIELD. „BULG. J. PLANT PHYSIOL.”, s. 15–24, 2001.
- ↑ Spreitzer R. J.. Questions about the complexity of chloroplast ribulose-1,5-bisphosphate carboxylase/oxygenase. „Photosynthesis Research”, s. 29-42, 1999.
- ↑ Kobayashi H., Takabe T., Nishimura M., Akazawa T. Role of the large and small subunits of ribulose-1,5-bisphosphate carboxylase in the activation by CO2 and Mg2+.. „Journal of biochemistry”, s. 923–30, kwiecień 1979. PMID: 37245.
- ↑ Spreitzer RJ. Role of the small subunit in ribulose-1,5-bisphosphate carboxylase/oxygenase.. „Archives of biochemistry and biophysics”, s. 141–9, czerwiec 2003. PMID: 12781765.
- ↑ Ott CM., Smith BD., Portis AR., Spreitzer RJ. Activase region on chloroplast ribulose-1,5-bisphosphate carboxylase/oxygenase. Nonconservative substitution in the large subunit alters species specificity of protein interaction.. „The Journal of biological chemistry”, s. 26241–4, sierpień 2000. DOI: 10.1074/jbc.M004580200. PMID: 10858441.
- ↑ Salvucci M. E. , Ogren W. L.. The mechanism of Rubisco activase: Insights from studies of the properties and structure of the enzyme. „Photosynthesis Research”, s. 1-11, 1996.
- ↑ Parry MA., Andralojc PJ., Mitchell RA., Madgwick PJ., Keys AJ. Manipulation of Rubisco: the amount, activity, function and regulation.. „Journal of experimental botany”, s. 1321–33, maj 2003. PMID: 12709478.
- ↑ Pierce J., Tolbert NE., Barker R. Interaction of ribulosebisphosphate carboxylase/oxygenase with transition-state analogues.. „Biochemistry”, s. 934–42, marzec 1980. PMID: 7356969.
- ↑ a b c Lincoln Taiz, Eduardo Zeiger: Plant physiology. Sunderland, MA: Sinauer Associates, 2006, s. 145-169. ISBN 978-0-87893-856-8.
- ↑ Raines CA. The Calvin cycle revisited.. „Photosynthesis research”, s. 1–10, 2003. DOI: 10.1023/A:1022421515027. PMID: 16245089.
- ↑ Marques IA., Ford DM., Muschinek G., Anderson LE. Photosynthetic carbon metabolism in isolated pea chloroplasts: metabolite levels and enzyme activities.. „Archives of biochemistry and biophysics”, s. 458–66, luty 1987. PMID: 3813547.
- ↑ Wolosiuk RA., Ballicora MA., Hagelin K. The reductive pentose phosphate cycle for photosynthetic CO2 assimilation: enzyme modulation.. „The FASEB journal : official publication of the Federation of American Societies for Experimental Biology”, s. 622–37, maj 1993. PMID: 8500687.
- ↑ Kruger NJ., von Schaewen A. The oxidative pentose phosphate pathway: structure and organisation.. „Current opinion in plant biology”, s. 236–46, czerwiec 2003. PMID: 12753973.
- ↑ Wolosiuk RA., Ballicora MA., Hagelin K. The reductive pentose phosphate cycle for photosynthetic CO2 assimilation: enzyme modulation.. „The FASEB journal : official publication of the Federation of American Societies for Experimental Biology”, s. 622–37, maj 1993. PMID: 8500687.
- ↑ Gutteridge S.. Limitations of the primary events of CO2 fixation in photosynthetic organisms: the structure and mechanism of rubisco. „Biochem Biophys Acta.”, s. 1–14, 1990.
- ↑ Whitman WB., Martin MN., Tabita FR. Activation and regulation of ribulose bisphosphate carboxylase-oxygenase in the absence of small subunits.. „The Journal of biological chemistry”, s. 10184–9, październik 1979. PMID: 114521.
- ↑ Liang C., Xiao W., Hao H., Xiaoqing L., Chao L., Lei Z., Fashui H. Effect of Mg2+ on the structure and function of ribulose-1,5-bisphosphate carboxylase/oxygenase.. „Biological trace element research”, s. 249–57, marzec 2008. DOI: 10.1007/s12011-007-8050-2. PMID: 17968513.
- ↑ Lemaire SD., Michelet L., Zaffagnini M., Massot V., Issakidis-Bourguet E. Thioredoxins in chloroplasts.. „Current genetics”, s. 343–65, czerwiec 2007. DOI: 10.1007/s00294-007-0128-z. PMID: 17431629.
- ↑ Schurmann P., Jacquot JP. PLANT THIOREDOXIN SYSTEMS REVISITED.. „Annual review of plant physiology and plant molecular biology”, s. 371–400, czerwiec 2000. DOI: 10.1146/annurev.arplant.51.1.371. PMID: 15012197.
- ↑ Trost P., Fermani S., Marri L., Zaffagnini M., Falini G., Scagliarini S., Pupillo P., Sparla F. Thioredoxin-dependent regulation of photosynthetic glyceraldehyde-3-phosphate dehydrogenase: autonomous vs. CP12-dependent mechanisms.. „Photosynthesis research”, s. 263–75, wrzesień 2006. DOI: 10.1007/s11120-006-9099-z. PMID: 17031544.
- ↑ Schürmann P., Buchanan BB. The ferredoxin/thioredoxin system of oxygenic photosynthesis.. „Antioxidants & redox signaling”, s. 1235–74, lipiec 2008. DOI: 10.1089/ars.2007.1931. PMID: 18377232.
- ↑ Graciet E., Lebreton S., Gontero B. Emergence of new regulatory mechanisms in the Benson-Calvin pathway via protein-protein interactions: a glyceraldehyde-3-phosphate dehydrogenase/CP12/phosphoribulokinase complex.. „Journal of experimental botany”, s. 1245–54, maj 2004. DOI: 10.1093/jxb/erh107. PMID: 15047759.
- ↑ Howard TP., Metodiev M., Lloyd JC., Raines CA. Thioredoxin-mediated reversible dissociation of a stromal multiprotein complex in response to changes in light availability.. „Proceedings of the National Academy of Sciences of the United States of America”, s. 4056–61, marzec 2008. DOI: 10.1073/pnas.0710518105. PMID: 18322016.
- ↑ Wedel N., Soll J. Evolutionary conserved light regulation of Calvin cycle activity by NADPH-mediated reversible phosphoribulokinase/CP12/ glyceraldehyde-3-phosphate dehydrogenase complex dissociation.. „Proceedings of the National Academy of Sciences of the United States of America”, s. 9699–704, sierpień 1998. PMID: 9689144.
- ↑ Ruben S. , Kamen M. D. , Hassid W. Z. , Devault D. C.. PHOTOSYNTHESIS WITH RADIO-CARBON. „Science”, s. 570 - 571, 1939. DOI: 10.1126/science.90.2346.570.
- ↑ Pennazio S. Photosynthesis: a short history of some modern experimental approaches.. „Rivista di biologia”. s. 73–86. PMID: 12852175.
- ↑ Ruben S., Kamen M. D.. Long-Lived Radioactive Carbon: C14. „Physical Review”, s. 349-354, 1941. DOI: 10.1103/PhysRev.59.349.
- ↑ Benson AA. Following the path of carbon in photosynthesis: a personal story.. „Photosynthesis research”, s. 29–49, 2002. DOI: 10.1023/A:1020427619771. PMID: 16245101.
- ↑ Bassham JA. Mapping the carbon reduction cycle: a personal retrospective.. „Photosynthesis research”, s. 35–52, 2003. DOI: 10.1023/A:1024929725022. PMID: 16228564.
Bibliografia
- Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydaw. Naukowe PWN, 2002. ISBN 83-01-13753-3.
