Odczynnik ferroksylowy
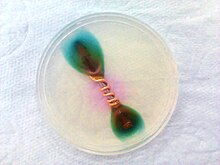
Odczynnik ferroksylowy – odczynnik chemiczny, roztwór NaCl, żelazicyjanku potasu (K
3[Fe(CN)
6]) i fenoloftaleiny. Ma on swoje zastosowanie przy doświadczeniu chemicznym okazującym przebieg procesu korozji. Pozwala na jednoczesną obserwację powstawania jonów OH−
i Fe2+
.
Przygotowanie odczynnika[1][edytuj | edytuj kod]
W celu przygotowania danego odczynnika należy zmieszać ze sobą:
- 10 cm3 3% NaCl
- 0,5 cm3 1% roztworu fenoloftaleiny
- 0,5 cm3 roztworu K
3[Fe(CN)
6]
Zastosowanie[1][edytuj | edytuj kod]
Odczynnik ferroksylowy stosuje się do wizualizacji występowania korozji elektrochemicznej żelaza w eksperymencie laboratoryjnym.
Aby przeprowadzić takie doświadczenie należy przygotować stalową płytkę, oczyścić ją i wkropić na jej powierzchnię kilka kropel odczynnika.
W procesie korozji elektrochemicznej żelazo z płytki ulega utlenieniu do jonów żelaza(II):
- Fe0
→ Fe2+
+ 2e−
Powstające jony Fe2+
reagują z jonami sześciocyjanożelazianowymi(III) [Fe(CN)
6]3−
obecnymi w odczynniku ferroksylowym, co prowadzi do powstania niebieskiego heksacyjanożelazianu(II) potasu żelaza(III) FeK[Fe(CN)
6][2], świadczącego o obecności w roztworze jonów żelaza(II):
- Fe2+
+ K+
+ 2[Fe(CN)
6]3−
→ FeK[Fe(CN)
6]
Powstający kompleks nazywa się błękitem Turnbulla
Jednocześnie zachodząca reakcja katodowa powoduje powstanie jonów hydroksylowych, które barwią dzięki swojemu zasadowemu odczynowi fenoloftaleinę na kolor różowy:
- 2H
2O + O
2 + 4e−
→ 4OH−
Z uwagi na szybciej zachodzący proces powstawania jonów hydroksylowych na brzegach kropli, to one barwią się najpierw na różowo, podczas gdy środek kropli ma kolor niebieski pochodzący od barwienia jonów żelaza(II).
Po czasie niebieska plamka na środku kropli zanika i powstaje w jej miejscu zielony osad powstający w wyniku reakcji błękitu Turnbulla z jonami OH−
z uwagi na jego nietrwałość w środowisku zasadowym:
- FeK[Fe(CN)
6] + 2OH−
→ [Fe(CN)
6]3−
+ Fe(OH)
2↓ + K+
Powstały wodorotlenek żelaza(II) reaguje z tlenem atmosferycznym, utleniając się do uwodnionego tlenku żelaza(III):
- 4Fe(OH)
2 + O
2 → 2Fe
2O
3·H
2O + 2H
2O
Przypisy[edytuj | edytuj kod]
- ↑ a b Krzysztof Maciej Pazdro, Chemia dla licealistów. Elektrochemia, Warszawa: Oficyna Edukacyjna Krzysztof Pazdro, 1996, ISBN 83-85751-36-X, OCLC 749607853.
- ↑ L.D. Hansen, W.M. Litchman, G.H. Daub, Turnbull’s blue and Prussian blue: KFe(III)[Fe(II)(CN)6], „Journal of Chemical Education”, 46 (1), 1969, s. 46, DOI: 10.1021/ed046p46.
