Proces Wackera
Proces Wackera (zwany też procesem Hoechsta-Wackera od firm w których został opracowany) – reakcja chemiczna bezpośredniego utleniania etenu do acetaldehydu tlenem w środowisku wodnym w obecności mieszanego chlorku palladu-miedzi (PdCl2•CuCl2) jako katalizatora homogenicznego[1]. Sumarycznie proces ten przedstawia poniższe równanie:

Proces Wackera został opublikowany w 1959 r. przez mieszany zespół chemików pracujących dla koncernów Wacker i Hoechst[1]. Było to pierwsze w historii udane zastosowanie homogenicznych katalizatorów palladu na skalę przemysłową[2].
Analogicznym procesem jest pierwszy etap reakcji Monsanto polegającej na utlenianiu propenu do kwasu octowego. Procesy Wackera i Monsanto zastąpiły w pewnym stopniu w przemyśle proces hydroformylowania, w wyniku którego również otrzymuje się z alkenów w środowisku wodnym aldehydy i ketony na skalę przemysłową. Różnica polega na tym, że reakcja hydroformylowania zachodzi z użyciem gazu syntezowego, jest katalizowana kompleksami rodu lub kobaltu i jest trudniejsza do kontroli, gdyż prowadzi zazwyczaj do otrzymania trudnej do rozdzielenia mieszaniny izomerów[3].
Mechanizm reakcji[edytuj | edytuj kod]
Sumarycznie przebieg reakcji można w uproszczony sposób przedstawić w formie następujących równań:
- [PdCl4]2- + C2H4 + H2O → CH3CHO + Pd0 + 2HCl + 2Cl- (1)
- Pd0 + 2CuCl2 + 2Cl- → [PdCl4]2- + 2CuCl (2)
- 2CuCl + ½O2 + 2HCl → 2CuCl2 + H2O (3)
Zgodnie z tymi równaniami chlorek palladu ulega stałemu odtwarzaniu, a w reakcji zużywa się tylko alken i tlen. Bez udziału chlorku miedzi powstający w wyniku reduktywnej eliminacji pallad(0) (równanie 1) wytrącałby się z układu reakcji, co powodowałoby zablokowanie procesu. Chlorek palladu(II) regenerowany jest z palladu(0) w drugim etapie procesu w wyniku utleniania przez chlorek miedzi(II). Trzeci etap prowadzi do odtworzenia chlorku miedzi(II), przy czym w tym etapie konsumowany jest też chlorowodór powstający w etapie (1).
Mimo wielu lat badań, na temat mechanizmu procesu Wackera istnieją wciąż kontrowersje. Dominujący od lat 90. XX w. pogląd na ten temat przedstawia poniższy schemat:[4]
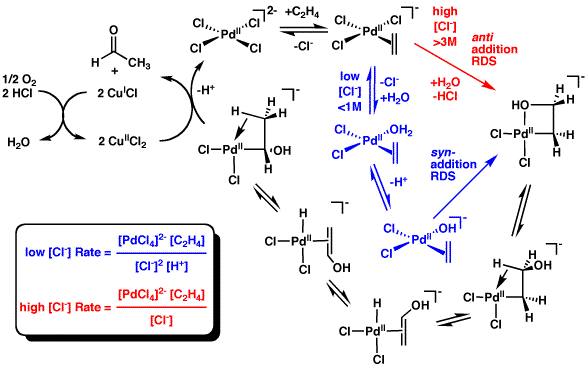
Większość dyskusji i badań z lat 1970-1991 nad tym mechanizmem dotyczyła kwestii, czy kluczowy dla tej reakcji atak nukleofilowy tlenu na alken zachodzi według ścieżki zewnętrznej anti-addycji na kompleks pallad-alken (czerwona ścieżka na schemacie), czy też w wyniku wewnętrznej syn-addycji bardziej złożonego kompleksu pallad-alken-OH2 (niebieska ścieżka na schemacie). Badania opublikowane przez Stille i współpracowników sugerowały wersję mechanizmu ze ścieżką anti-addycji[5], jednak później ci sami autorzy odrzucili tę koncepcję, gdy okazało się, że modele kinetyczne tej reakcji oparte na proponowanym mechanizmie nie sprawdzają się w praktyce[6][7]. Dalsze badania kinetyki wskazały, że reakcja ta zachodzi prawdopodobnie według obu mechanizmów naraz, zaś to, który z nich dominuje zależy od stężenia jonów chlorkowych w układzie[8]. Ustalono, że syn-addycja dominuje przy niskim stężeniu jonów chlorkowych (< 1 mol/L), które występują w typowych warunkach przemysłowych prowadzenia tej reakcji, zaś przy stężeniu powyżej 3 mol/L występuje prawie wyłącznie anti-addycja. Potwierdzają to też badania stereochemii reakcji opublikowane przez Patricka M. Henry'ego w 1991[9][10]. Nie wyjaśniono jednak powodów dla których zmiana stężenia jonów chlorkowych powoduje zmianę tego etapu mechanizmu reakcji.
Drugim kluczowym etapem procesu Wackera jest migracja atomu wodoru z tlenu do chloru z utworzeniem podwójnego wiązania C=O. Ogólnie uważa się, że proces ten odbywa się poprzez tzw. eliminację β-wodorkową z utworzeniem cyklicznego, czteroatomowego stanu przejściowego, podobnie jak ma to miejsce w wielu innych mechanizmach reakcji katalizowanych metaloorganicznie:
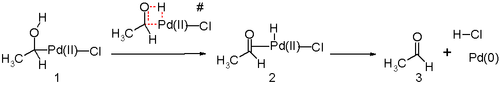
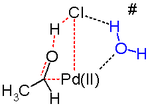
Symulacje komputerowe opublikowane w 2006 r. są argumentem na rzecz tezy, że proponowany, cykliczny, czteroatomowy stan przejściowy jest energetycznie bardzo niekorzystny (energia aktywacji rzędu 36,6 kcal/mol). W świetle tych badań bardziej prawdopodobne wydaje się zachodzenie tego etapu reakcji poprzez reduktywną eliminację, w której proton bezpośrednio przyłącza się do chloru, zaś energia postulowanego stanu pośredniego, z uwzględnieniem asysty cząsteczki wody wynosi tylko 18.8 kcal/mol[11].
Utlenianie Wackera-Tsuji[edytuj | edytuj kod]
Tzw. utlenianie Wackera-Tsuji to wersja procesu Wackera prowadzona w skali laboratoryjnej z innymi niż eten alkenami, na przykład przekształcenie dek-1-enu do 2-dekanonu w mieszaninie woda/DMF z użyciem powietrza jako środka utleniającego[12].
Przypisy[edytuj | edytuj kod]
- ↑ a b J. Smidt, W. Hafner, R. Jira, J. Sedlmeier, R. Sieber, R. Ruttinger and H. Kojer, Angew. Chem., 1959, 71, 176; J. Smidt, W. Hafner, R. Jira, R. Sieber, J. Sedlmeier and J. Sabel, Angew. Chem., Int. Ed. Engl., 1962, 1, 80; J. Smidt, Chem. Ind., 1962, 54.
- ↑ Jiro Tsuji. Organopalladium chemistry in the '60s and '70s. „New J. Chem.”, s. 127, 2005. DOI: 10.1039/a909473c.
- ↑ Boy Cornils, Wolfgang A. Herrmann (red.): Aqueous-Phase Organometallic Catalysis: Concepts and Applications. Weinheim: Wiley-VCH, 2004. [dostęp 2009-05-06].ISBN 3-527-30712-5 /ISBN 978-3-527-30712-8
- ↑ Henry, Patrick M. In Handbook of Organopalladium Chemistry for Organic Synthesis; Negishi, E., Ed.; Wiley & Sons: New York, 2002; p 2119. ISBN 0-471-31506-0
- ↑ D.E. James, J.K. Stille, The palladium(II) catalyzed olefin carbonylation reaction. Mechanisms and synthetic utility, „Journal of the American Chemical Society”, 98 (7), 1976, s. 1810–1823, DOI: 10.1021/ja00423a028, ISSN 0002-7863.
- ↑ Stille, J.K., Divakarumi, R.J., J. Organomet. Chem., 1979, 169, 239;
- ↑ D.E. James, L.F. Hines, J.K. Stille, The palladium(II) catalyzed olefin carbonylation reaction. The stereochemistry of methoxypalladation, „Journal of the American Chemical Society”, 98 (7), 1976, s. 1806–1809, DOI: 10.1021/ja00423a027, ISSN 0002-7863.
- ↑ J.E. Baeckvall, B. Akermark, S.O. Ljunggren, Stereochemistry and mechanism for the palladium(II)-catalyzed oxidation of ethene in water (the Wacker process), „Journal of the American Chemical Society”, 101 (9), 1979, s. 2411–2416, DOI: 10.1021/ja00503a029, ISSN 0002-7863.
- ↑ John W. Francis, Patrick M. Henry, Palladium(II)-catalyzed exchange and isomerization reactions. 14. Kinetics and stereochemistry of the isomerization and water exchange of 2-(methyl-d3)-4-methyl-1,1,1,5,5,5-hexafluoro-3-penten-2-ol in aqueous solution catalyzed by PdCl42-. Two new mechanistic probes for catalytic chemistry, „Organometallics”, 10 (10), 1991, s. 3498–3503, DOI: 10.1021/om00056a019, ISSN 0276-7333.
- ↑ John W. Francis, Patrick M. Henry, Palladium(II)-catalyzed exchange and isomerization reactions. 15. Kinetics and stereochemistry of the isomerization of 2-(methyl-d3)-4-methyl-1,1,1,5,5,5-hexafluoro-3-penten-2-ol in aqueous solution catalyzed by PdCl42- at high chloride concentrations, „Organometallics”, 11 (8), 1992, s. 2832–2836, DOI: 10.1021/om00044a024, ISSN 0276-7333.
- ↑ John A. Keith, Jonas Oxgaard, William A. Goddard, Inaccessibility of β-Hydride Elimination from −OH Functional Groups in Wacker-Type Oxidation, „Journal of the American Chemical Society”, 128 (10), 2006, s. 3132–3133, DOI: 10.1021/ja0533139, ISSN 0002-7863.
- ↑ Jiro Tsuji, Hideo Nagashima, Hisao Nemoto, General Synthetic Method for the preparation of Methyl Ketones from Terminal Olefins: 2-Decanone, Organic Syntheses, Coll. Vol. 7, p.137 (1990); Vol. 62, p.9 (1984).
