Reakcja Petersona
Reakcja Petersona (zwana także olefinacją Petersona i eliminacją Petersona) - reakcja chemiczna między karboanionem z grupą sililową w pozycji α a ketonami lub aldehydami w wyniku której tworzy się w pierwszym etapie β-hydroksysilan, który następnie ulega spontanicznej eliminacji z utworzeniem alkenu.[1]

Reakcja ta jest powszechnie stosowana do selektywnej syntezy alkenów. Atrakcyjną cechą tej reakcji jest fakt, że w odpowiednich warunkach można w jej wyniku z tych samych substratów otrzymać selektywnie oba izomery geometryczne tego samego alkenu. O tym czy powstanie izomer cis lub trans decyduje pH środowiska w drugim etapie reakcji, kiedy następuje eliminacja β-hydroksysilanu. W literaturze dostępnych jest kilka przeglądów zastosowań i analiz mechanizmu tej reakcji.[2][3][4][5]
Mechanizm[edytuj | edytuj kod]
Mechanizm reakcji zależy od pH środowiska w którym się ją prowadzi oraz w pewnym stopniu od podstawników zarówno przy grupie sililowej jak i przy związku karbonylowym.
Eliminacja zasadowa[edytuj | edytuj kod]
Działanie zasadą na β-hydroksysilan (1) powoduje skoordynowaną eliminację w pozycji syn (2 lub 3) co prowadzi do powstania oczekiwanego alkenu. Istnieje hipoteza, że reakcja ta przebiega poprzez produkty z pięciowiązalnym atomem krzemu, brak jest jednak na to bezpośrednich dowodów.
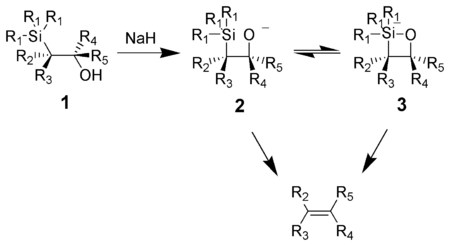
W reakcji tej najbardziej efektywnym katalizatorem jest wodorek potasu, który działa już w temperaturze pokojowej. Katalizatory sodowe wymagają ogrzewania mieszaniny reakcyjnej, a magnezowe działają dopiero w skrajnych warunkach.
Eliminacja kwasowa[edytuj | edytuj kod]
Działanie kwasem na β-hydroksysilan (1) prowadzi do jego protonowania i eliminacji w pozycji anti, na skutek czego powstaje alken będący przeciwnym izomerem geometrycznym do tego jaki by można było otrzymać w warunkach zasadowych:

Wpływ podstawników alkilowych[edytuj | edytuj kod]
Kiedy wyjściowy karboanion α-sililowy zawiera tylko grupy alkilowe, atomy wodoru lub podstawniki elektrofilowe kontrola stereochemiczna reakcji Petersona jest łatwa do zrealizowania gdyż eliminacja w niskiej temperaturze jest na tyle powolna, że można bez trudu wyizolować β-hydroksysilan.[6] Po wyizolowaniu tego produktu pośredniego można następnie odpowiednio poddać go reakcji z kwasem lub zasadą aby uzyskać pożądany izomer geometryczny alkenu.[4]
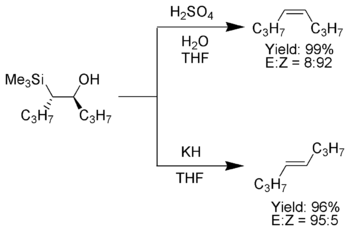
Wpływ podstawników nukleofilowych[edytuj | edytuj kod]
Gdy wyjściowy karboanion α-sililowy zawiera podstawniki nukleofilowe reakcja przebiega zbyt szybko aby dało się wyodrębnić produkt pośredni - odpowiedni β-hydroksysilan. Obecność karboanionu powoduje, że środowisko reakcji jest słabo zasadowe, zatem w tym przypadku możliwe jest otrzymanie tylko jednego z dwóch produktów eliminacji lub ich mieszaniny.
Odmiany reakcji[edytuj | edytuj kod]
Eliminacja kwasowa nie zawsze daje oczekiwane produkty, gdyż obecność kwasów prowadzi czasami do ubocznej reakcji izomeryzacji. Z drugiej strony stosowanie silnie redukujących wodorków sodu lub potasu może prowadzić do ubocznych reakcji z niektórymi podstawnikami. Stąd poszukuje się metod prowadzenia tej reakcji w łagodniejszych warunkach.
Zespół Chana odkrył, że acylowanie β-hydroksysilanu przy pomocy chlorku acetylu lub chlorku tionylu prowadzi do otrzymania β-sililowego estru, który następnie ulega spontanicznej eliminacji w 25 °C prowadząc do oczekiwanego alkenu bez użycia kwasów i zasad.[7]
Corey i współpracownicy opracowali metodę, nazywaną czasem olefinacją Coreya-Petersona[8], w której stosuje się sililowaną iminę aby otrzymać α,β-nienasycony aldehyd z wyjściowego związku karbonylowego w jednym etapie.[9] Ten wariant olefinacji jest stosowany w praktyce przy syntezie totalnej taksolu.
Przypisy[edytuj | edytuj kod]
- ↑ D. J. Peterson. Carbonyl olefination reaction using silyl-substituted organometallic compounds. „J. Org. Chem.”. 33. 2, s. 780-784, 1968. DOI: 10.1021/jo01266a061.
- ↑ Birkofer, L.; Stiehl, O. Top. Curr. Chem. 1980, 88, 58. (Review)
- ↑ Ager, D. J. Synthesis 1984, 384-398. (Review)
- ↑ a b Ager, D. J. Org. React. 1990, 38, 1-223. (Review)
- ↑ T. H. Chan. Alkene synthesis via β-functionalized organosilicon compounds. „Acc. Chem. Res.”. 10. 12, s. 442-448, 1977. DOI: 10.1021/ar50120a003.
- ↑ Barrett, A. G. M.; Flygare, J. A.; Hill, J. M.; Wallace, E. M.. Stereoselective Alkene Synthesis via 1-Chloro-1-[(dimethyl)phenylsilyl]alkanes and α-(Dimethyl)phenylsilyl Ketones: 6-Methyl-6-dodecene. „OrgSynth”. 9, s. 580, 1998.
- ↑ T. H. Chan and E. Chang. Synthesis of alkenes from carbonyl compounds and carbanions alpha to silicon. III. Full report and a synthesis of the sex pheromone of gypsy moth. „J. Org. Chem.”. 39. 22, s. 3264-3268, 1974. DOI: 10.1021/jo00936a020.
- ↑ X. Zeng, F. Zeng and E. Negishi. Efficient and Selective Synthesis of 6,7-Dehydrostipiamide via Zr-Catalyzed Asymmetric Carboalumination and Pd-Catalyzed Cross-Coupling of Organozincs. „Org. Lett.”. 6. 19, s. 3245-3248, 2004. DOI: 10.1021/ol048905v.
- ↑ E. J. Corey, D. Enders and M. G. Bock. A simple and highly effective route to α-β-unsaturated aldehydes. „Tetrahedron Letters”. 17. 1, s. 7-10, 1976. DOI: 10.1016/S0040-4039(00)71308-6.
