Seria Balmera

Seria Balmera – seria linii widmowych wodoru, w spektrum światła widzialnego. Linie tej serii powstają, kiedy elektron w atomie wodoru przechodzi ze stanu o głównej liczbie kwantowej n > 2 do stanu n = 2 (tzn. kiedy elektron przechodzi z wyższej powłoki na powłokę 2) (seria L)[1].
Linie Balmera w spektrum światła widzialnego mają długości fal: 656 nm (czerwona H-α), 486 nm (niebiesko-zielona H-β), 434 nm (linia niebieska H-γ) oraz 410 nm (linia fioletowa H-δ)[2]. Ostatnia z wymienionych linii (H-δ o długości 410 nm) znajduje się na granicy pomiędzy światłem widzialnym a promieniowaniem ultrafioletowym. Poszczególne linie odpowiadają emisji promieniowania elektromagnetycznego o danej długości fali przez atom wodoru przechodzący do stanu o niższej energii. Chodzi tutaj wyłącznie o przejścia elektronów z powłok wyższych do powłoki 2 (ale nie 1). Linia H-α odpowiada emisji przy przejściu elektronu z powłoki 3 do 2. Linia H-β odpowiada przejściu elektronu z powłoki 4 do 2. Linia H-γ odpowiada przejściu elektronu z powłoki 5 do 2. Linia H-δ odpowiada przejściu elektronu z powłoki 6 do 2. Przejście elektronów z jeszcze wyższych powłok do powłoki 2 będzie dawać linie widmowe o falach jeszcze krótszych, właściwie już w spektrum ultrafioletu, ale coraz gęściej umiejscowionych (tj. będą znajdować się coraz bliżej siebie). Można też obliczyć, jaką będzie mieć długość fali promieniowanie wyemitowane przez przejście do 2 powłoki elektronu z powłoki o wartości n dążącej do nieskończoności. W ten sposób pozyska się graniczną długość fali 364,6 nm. Przejście elektronu z dowolnej powłoki do powłoki 2 nigdy tej granicy nie przekroczy w dół, tzn. seria Balmera nie uzyska już linii o krótszej długości fali.
Natomiast przejście elektronu z jakiejś wyższej powłoki do powłoki jeszcze niższej, a więc do powłoki 1, odpowiada za emisję promieniowania o długości fali znacznie krótszej, niż wartość graniczna 364,6 nm. Takie przejścia utworzą kolejne linie emisyjne, ale w spektrum dalekiego ultrafioletu, które to linie nazywane są serią Lymana[3].
Seria Balmera i formuła do wyznaczania jej składników została odkryta w wyniku obserwacji widma wodoru przez Johanna Balmera w 1885[4].
Wszystkie serie linii widmowych wodoru, według docelowej powłoki elektronowej, na którą przechodzi elektron z jakiejś wyższej powłoki (czyli wg wartości liczby kwantowej ):
- seria Lymana
- seria Balmera
- seria Paschena
- seria Bracketta
- seria Pfunda
- seria Humphreysa.
Historia[edytuj | edytuj kod]
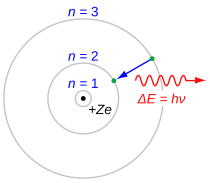
Serię Balmera cechuje przejście elektronu z na gdzie n oznacza radialną lub główną liczbe kwantową elektronu. Przejścia są nazwane kolejnym literami alfabetu greckiego: przejście z do nazywa się H-α, przejście z 4 do 2 to jest H-β, przejście z 5 do 2 to jest H-γ oraz z 6 do 2 to H-δ. Ponieważ pierwsze linie widmowe związane z tą serią są umieszczone w widzialnej części widma elektromagnetycznego, linie te są tradycyjnie określane jako „H-alfa”, „H-beta”, „H-gamma” itd., gdzie H jest oznaczeniem pierwiastka wodoru.
| Przejście | 3→2 | 4→2 | 5→2 | 6→2 | 7→2 | 8→2 | 9→2 | →2 |
|---|---|---|---|---|---|---|---|---|
| Nazwa | H-α / Ba-α | H-β / Ba-β | H-γ / Ba-γ | H-δ / Ba-δ | H-ε / Ba-ε | H-ζ / Ba-ζ | H-η / Ba-η | |
| Długość fali [nm][5] | 656,3 | 486,1 | 434,1 | 410,2 | 397,0 | 388,9 | 383,5 | 364,6 |
| Różnica potencjału [eV] | 1,89 | 2,55 | 2,86 | 3,03 | 3,13 | 3,19 | 3,23 | 3,40 |
| Kolor | czerwony | morski | niebieski | fiolet | (ultrafiolet) | (ultrafiolet) | (ultrafiolet) | (ultrafiolet) |
Chociaż fizycy byli świadomi emisji atomowej przed rokiem 1885, nie posiadali oni narzędzia, za pomocą którego mogliby dokładnie przewidzieć, gdzie powinny pojawić się linie widmowe. Równanie Balmera przewiduje z dużą dokładnością cztery widoczne linie absorpcji / emisji wodoru. Na podstawie równania Balmera powstał Wzór Rydberga (uogólniona wersja), co z kolei sprawiło iż fizycy odkryli serie Lymana, Paschena i Bracketta, które przewidywały istnienie innych linii absorpcji / emisji wodoru. Zostały one znalezione poza światłem widzialnym.
Poznana czerwona linia widmowa wodoru H-alfa, która jest przejściem od powłoki do powłoki Balmera jest jednym z widocznych kolorów wszechświata. Przyczynia się ona do występowania jasnej czerwonej linii w widmach mgławic emisyjnych lub jonizacyjnych (jak w przypadku Wielkiej Mgławicy w Orionie), które są często Rejonami typu H II znajdującymi się w o w rejonach formowania się gwiazd. Na zdjęciach wykonanych w świetle widzialnym, te mgławice mają wyraźny różowy kolor, wynikający z kombinacji widocznych linii Balmera, emitowanych przez wodór.
Później stwierdzono, iż linie widmowe wodoru – badane w bardzo wysokiej rozdzielczości – wyglądają jak dublety, znajdujące się blisko siebie. To rozszczepienie nazywane jest „subtelną strukturą”. Stwierdzono również, że wzbudzone elektrony mogą przeskoczyć do stanu z takich orbitali, gdzie było większe niż 6, emitując odcienie fioletu w trakcie „przeskoku”.
Równanie Balmera[edytuj | edytuj kod]

Balmer zauważył, że pojedyncza liczba miała związek z każdą z linii w widmie wodoru, który był w regionie światła widzialnego. Ta liczba miała wartość 364,50682 nm. Gdy dowolna liczba całkowita większa od 2 została podniesiona do kwadratu, a następnie podzielona przez swój kwadrat pomniejszony o 4, wówczas ta liczba pomnożona przez 364,50682 (patrz równanie poniżej) dała w wyniku wartość długości fali innej linii w widmie wodoru. Dzięki tej formule, Balmer był w stanie wykazać, że niektóre pomiary linii wykonanych metodą spektroskopii w jego czasach były nieco niedokładne. Jego formuła natomiast przewidziała istnienie linii, które co prawda później zostały wykryte, ale nie zostały jeszcze zaobserwowane. Jego liczba okazała się być również graniczną wartością serii.
Równanie Balmera może być wykorzystane w celu odszukania długości fali linii absorbujących oraz emisyjnych. Jego pierwotna postać wyglądała następująco (z wyjątkiem oznaczenia stałej Balmera literą które zostało wprowadzone później):
gdzie:
- – długość fali,
- – stała o wartości 3,6450682×10−7 m (lub też 364,50682 nm),
- – równe 2,
- – liczba całkowita taką, że
W roku 1888 fizyk Johannes Rydberg uogólnił równanie Balmera dla wszystkich przejść wodoru. Równanie powszechnie stosowane do obliczania serii Balmera jest specyficznym przykładem wzoru Rydberga i jest ono otrzymywane poprzez proste, wzajemne przekształcenia powyższego wzoru (zwykle stosuje się literę zamiast w celu oznaczenia wymaganej stałej liczby całkowitej):
gdzie jest długością fali zaabsorbowanego/wyemitowanego światła, a jest Stałą Rydberga dla wodoru. W równaniu Balmera, stała Rydberga pozornie przyjmuje wartość natomiast – w przypadku jądra o nieskończenie dużej masie – wynosi metra = metra[6].
Zastosowanie w astronomii[7][edytuj | edytuj kod]
Serie Balmera są szczególnie użyteczne w astronomii, ponieważ linie Balmera pojawiają się w licznych obiektach gwiezdnych przedmiotów ze względu na dużą ilość wodoru we wszechświecie, tym samym są powszechnie widoczne i stosunkowo wyraźne w stosunku do innych linii.
Widmowa klasyfikacja gwiazd – która przede wszystkim służy do określenia temperatury powierzchni – bazuje na względnej intensywności linii widmowych, a w szczególności serie Balmera są bardzo ważne. Inne cechy gwiazdy, które można określić poprzez ścisłą analizę jej widma, a także jej grawitacji (w odniesieniu do wielkości fizycznej) oraz składu.
Ponieważ linie Balmera są powszechnie dostrzegane w widmach różnych obiektów, są one często wykorzystywane do określenia prędkości radialnej spowodowanych efektem Dopplera wobec linii Balmera. Ten fakt ma istotne zastosowanie w całej astronomii, m.in. przy:
- wykrywaniu podwójnych gwiazd oraz egzoplanet,
- wykrywaniu gęstych obiektów, takich jak gwiazdy neutronowe i czarne dziury (poprzez ruch wodoru w dysku akrecyjnym wokół nich),
- identyfikacji grup obiektów o podobnych ruchach i ustalaniu ich przypuszczalnego pochodzenia (gromady gwiazd, gromady galaktyk i pozostałości po kolizjach),
- określaniu odległości (w rzeczywistości przesunięć ku czerwieni) galaktyk oraz kwazarów,
- identyfikacji nieznanych obiektów na podstawie analizy ich widma.
Linie Balmera mogą pojawiać się w widmie jako linie absorpcyjne lub emisyjne linie, w zależności od natury obserwowanego obiektu. W Gwiazdach, linie Balmera są zazwyczaj postrzegane jako absorpcyjne i są one „najsilniejsze” w gwiazdach o temperaturze powierzchni około 10 000 kelwinów (typu widmowego A). W widmach większości spiralnych, nieregularnych oraz aktywnych galaktyk, obszarach H II, a także w mgławicach planetarnych, linie Balmera są liniami emisyjnymi.
W widmie gwiazdowym, linia H-epsilon (przejście 7-2) często miesza się z inną linią absorpcyjną spowodowane przez zjonizowane cząstki wapnia, który znany jest astronomom jako „H” (oryginalne oznaczenie podane przez Fraunhofera). Oznacza to, że długość fali H-epsilon jest dość blisko CaH przy wartości rzędu 396,847 nm, i nie może być analizowana w widmach o niskiej rozdzielczości. Linia H-zeta (przejście 8-2) w podobny sposób miesza się z neutralnym helem, widzianym w gorących gwiazdach.
Przypisy[edytuj | edytuj kod]
- ↑ Balmer series | COSMOS [online], astronomy.swin.edu.au [dostęp 2017-11-26] (ang.).
- ↑ Balmer’s Formula [online], www.colorado.edu:80 [dostęp 2018-10-07] [zarchiwizowane z adresu 2016-05-30].
- ↑ C.R. Nave (2006). HyperPhysics: Hydrogen Spectrum. Georgia State University. Accessed March 1st, 2008.
- ↑ J.J. Balmer. Notiz über die Spectrallinien des Wasserstoffs. „Annalen der Physik”. 261 (5), s. 80–87, 1885. DOI: 10.1002/andp.18852610506. (niem.).
- ↑ Eisberg and Resnick: Quantum Physics. John Wiley and Sons, 1985, s. 97.
- ↑ CODATA Recommended Values of the Fundamental Physical Constants: 2006. [w:] Committee on Data for Science and Technology (CODATA) [on-line]. NIST.
- ↑ Guide to Spectroscopy and Spectral Lines | astrobites [online], astrobites.org [dostęp 2017-11-26] (ang.).




















