Rak przełyku
| carcinoma oesophagi | |
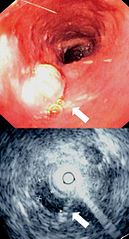 Endoskopowy i ultrasonograficzny obraz (EUS) raka przełyku | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|
Rak przełyku (łac. carcinoma oesophagi) – nowotwór złośliwy przełyku, wywodzący się z nabłonka płaskiego – rak płaskonabłonkowy (carcinoma planoepitheliale), lub gruczołowego – rak gruczołowy (adenocarcinoma). Jego najczęstszym objawem jest dysfagia. Rozpoznanie stawia się na podstawie badania wycinków pobranych podczas endoskopii. Leczenie opiera się głównie na chirurgii (w przypadku zaawansowanych nowotworów również chemioterapii i radioterapii). Rokowanie jest złe.
Epidemiologia
[edytuj | edytuj kod]Zapadalność: 3,4/100000/rok. Rocznie rozpoznaje się w Polsce około 1300 przypadków raka przełyku. Częściej chorują mężczyźni, prawie wyłącznie po 40. roku życia. Dynamizm wzrostu zachorowalności na gruczolakoraka przełyku jest największy spośród wszystkich rodzajów raka u ludzi (związane jest to ze wzrastającą częstością występowania przełyku Barreta).
Etiopatogeneza
[edytuj | edytuj kod]Rozwój raka przełyku jest spowodowany zaburzeniami kontroli proliferacji i różnicowania oraz apoptozy komórkowej. Dochodzi do mutacji w obrębie genów supresorowych, takich jak: p53, p21, p14, p16, a także onkogenów – Bcl-1.
Czynniki ryzyka
[edytuj | edytuj kod]Czynniki etiologiczne:
- palenie papierosów oraz fajki wodnej
- alkohol
- gorące napoje
- otyłość zwiększa ryzyko gruczolakoraka 4-krotnie[1]
- niski status socjoekonomiczny[2]
- refluks żołądkowo-przełykowy
- rak głowy i szyi w wywiadzie
- stan po radioterapii śródpiersia
- nitrozoaminy
- aflatoksyna
- orzeszki betelu
- wirusy brodawczaka ludzkiego (HPV-16[3])
Stany przedrakowe:

- przełyk Barretta
- wieloletnia achalazja
- oparzenia przełyku
- modzelowatość
- zespół Plummera-Vinsona
- zwężenia pozapalne i po oparzeniach
- brodawczak płaskonabłonkowy
Największym czynnikiem ryzyka gruczolakoraka przełyku jest przełyk Barretta.
Postaci
[edytuj | edytuj kod]- Rak płaskonabłonkowy – najczęstszy (85%)
- Gruczolakorak – zachorowalność wzrasta
- Rak śluzowonaskórkowy
- Rak torbielowatogruczołowy
Dwa ostatnie spotykane są bardzo rzadko.
Rzadkie są także inne typy histologiczne raka przełyku: rak płaskonabłonkowy bazaloidny, rak wrzecionowatokomórkowy, rak płaskonabłonkowy brodawkowaty[4].
Objawy
[edytuj | edytuj kod]Najczęściej:
- dysfagia
- zmniejszenie masy ciała
- odynofagia
Rzadziej:
Powiększenie nadobojczykowych i szyjnych węzłów chłonnych świadczy o znacznym zaawansowaniu procesu chorobowego.
Umiejscowienie
[edytuj | edytuj kod]Najczęściej w obrębie 3 fizjologicznych przewężeń:
- przy wejściu do przełyku w miejscu zespolenia z gardłem – 15%
- w miejscu rozwidlenia tchawicy – 50%
- przy przejściu przez rozwór przepony – 35%
Powikłania
[edytuj | edytuj kod]Przetoka przełykowo-tchawicza
Objawy:
Rozpoznanie
[edytuj | edytuj kod]
Na podstawie badania endoskopowego i oceny histopatologicznej pobranego wycinka.
W celu ustalenia stopnia zaawansowania choroby należy wykonać następujące badania:
- bronchoskopię – ustalenie stopnia ucisku na tchawicę lub oskrzela
- PET – ocena miejscowego zaawansowania i przerzutów.
Badania pomocnicze
[edytuj | edytuj kod]- badanie radiologiczne przełyku po podaniu kontrastu – może wykazać owrzodzenia lub zwężenia przełyku
- endoskopia – umożliwia wykrycie zmiany płaskiej w ścianie przełyku, owrzodzenia, guza wpuklającego się do światła przełyku, usztywnienia ściany spowodowanego naciekiem lub zwężenia przełyku.
- tomografia komputerowa – diagnostyka przerzutów odległych i określenie stopnia zaawansowania choroby
- endosonografia (EUS) – ocena głębokości penetracji raka w obrębie przełyku i sąsiadujących struktur, a także zajęcie regionalnych węzłów chłonnych. Umożliwia także wykonanie celowanej biopsji cienkoigłowej węzła chłonnego.
- markery nowotworowe (CEA, CA 19-9, CA 125) – mała czułość i swoistość. Mogą być przydatne w monitorowaniu nawrotów.
Różnicowanie
[edytuj | edytuj kod]Inne przyczyny dysfagii (patrz odpowiedni rozdział).
Klasyfikacja TNM
[edytuj | edytuj kod]| T – guz pierwotny | |
| Tis | carcinoma in situ |
| T1 | guz nacieka błonę podśluzową, ale jej nie przekracza |
| T2 | guz nacieka błonę mięśniową, ale jej nie przekracza |
| T3 | rak nacieka przydankę przełyku |
| T4 | rak nacieka otaczające tkanki |
| N – okoliczne węzły chłonne | |
| N0 | regionalne węzły chłonne bez przerzutów nowotworu |
| N1 | zajęty okoliczny węzeł chłonny |
| M – przerzuty odległe | |
| M0 | nie stwierdza się przerzutów odległych |
| M1a | stwierdza się przerzuty do węzłów chłonnych szyjnych w raku górnej połowy przełyku lub do węzłów chłonnych pnia trzewnego w raku dolnej połowy przełyku |
| M1b | inne odległe przerzuty |
Stopień zaawansowania
[edytuj | edytuj kod]| Stopień 0 | Tis | N0 | M0 |
| Stopień I | T1 | N0 | M0 |
| Stopień IIA | T2-3 | N0 | M0 |
| Stopień IIB | T1-2 | N1 | M0 |
| Stopień III | T3 | N1 | M0 |
| T4 | każde N | M0 | |
| Stopień IVA | każde T | każde N | M1a |
| Stopień IVB | każde T | każde N | M1b |
Leczenie
[edytuj | edytuj kod]Leczenie radykalne
[edytuj | edytuj kod]Kwalifikują się do niego tylko chorzy bez przerzutów. Wybór metody zależy od stopnia zaawansowania choroby:
- T1 N0 M0 – wstępna operacja lub wstępna chemioterapia (stosuje się 5-fluorouracyl i cisplatynę)
- T4 N1 M0 – nowotwór nieoperacyjny, wstępna chemioradioterapia
- T2/3 N0 M0/1a – wstępna operacja + terapia adiuwantowa; wstępna chemioradioterapia; chemoradioterapia neoadiuwantowa z późniejszą operacją
Podstawową metodą operacyjną w leczeniu raka przełyku jest jego całkowite lub subtotalne wycięcie wraz z okolicznymi węzłami chłonnymi. Ciągłość przewodu pokarmowego odtwarza się przez przemieszczenie żołądka do klatki piersiowej lub wytworzenia wstawki z jelita.
Leczenie paliatywne
[edytuj | edytuj kod]
Metody:
- radiochemioterapia
- elektrokoagulacja
- terapia laserowa
- koagulacja argonowa
- terapia fotodynamiczna – 72 h po podaniu substancji uczulającej na światło (np. hematoporfiryny) stosuje się napromienianie guza laserem. Wcześniejsze podanie fotouczulacza prowadzi do powstania wolnych rodników w guzie. Powodują one destrukcję błony komórkowej, śmierć komórki i martwicę guza.
- protezowanie przełyku
- gastrostomia
Leczenie ma na celu zminimalizowanie objawów i poprawę jakości życia pacjentów z nieoperacyjnym rakiem przełyku.
Rokowanie
[edytuj | edytuj kod]| Stopień | 5-letnie przeżycie |
|---|---|
| 0 | >95% |
| I | 50-80% |
| IIA | 30-40% |
| IIB | 10-30% |
| III | 10-15% |
| IVA | <5% |
| IVB | <1% |
W większości przypadków rozpoznanie raka przełyku następuje w stadium zaawansowanym, dlatego średni odsetek przeżyć wynosi 5-10%.
Profilaktyka
[edytuj | edytuj kod]Przede wszystkim opiera się na modyfikacji stylu życia:
- leczenie otyłości
- zaprzestanie palenia tytoniu
- spożywanie świeżych owoców i warzyw.
Regularne badania endoskopowe chorych ze zwiększonym ryzykiem zachorowania.
Klasyfikacja ICD10
[edytuj | edytuj kod]| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: C15 | Rak przełyku |
| ICD-10: C15.0 | Szyjna część przełyku |
| ICD-10: C15.1 | Piersiowa część przełyku |
| ICD-10: C15.2 | Brzuszna część przełyku |
| ICD-10: C15.3 | Górna trzecia część przełyku |
| ICD-10: C15.4 | Środkowa trzecia część przełyku |
| ICD-10: C15.5 | Dolna trzecia część przełyku |
| ICD-10: C15.9 | Przełyk, nieokreślony |
Przypisy
[edytuj | edytuj kod]- ↑ AH. Merry, LJ. Schouten, RA. Goldbohm, PA. van den Brandt. Body mass index, height and risk of adenocarcinoma of the oesophagus and gastric cardia: a prospective cohort study.. „Gut”. 56 (11), s. 1503-11, Nov 2007. DOI: 10.1136/gut.2006.116665. PMID: 17337464.
- ↑ Farin Kamangar i inni, Environmental Causes of Esophageal Cancer, „Gastroenterology clinics of North America”, 1, 2009, 27–vii, DOI: 10.1016/j.gtc.2009.01.004, ISSN 0889-8553, PMID: 19327566, PMCID: PMC2685172 [dostęp 2016-06-01].
- ↑ KJ. Syrjänen. HPV infections and oesophageal cancer.. „J Clin Pathol”. 55 (10), s. 721-8, Oct 2002. PMID: 12354793.
- ↑ Vinay Kumar, Abul K. Abbas, Jon C. Aster, Robbins PATOLOGIA, wyd. II polskie, Wrocław: Elsevier Urban & Partner, 2017, s. 619, ISBN 978-1-4377-1781-5.
Bibliografia
[edytuj | edytuj kod]- "Choroby wewnętrzne" pod red. prof. dr hab. Andrzeja Szczeklika, tom 1, str. 761–763 ISBN 83-7430-031-0
- "Interna" pod red. prof. dr hab. Franciszka Kokota, tom 1, str. 444–445 ISBN 83-200-2871-X
- "Medycyna wewnętrzna" Gerd Herold i współautorzy, str. 506–508 ISBN 83-200-3322-5
- "Chirurgia" Bruce E. Jarrel, R. Anthony Carabasi, III, str. 212–213 ISBN 83-85842-56-X
- Zastosowanie terapii fotodynamicznej w paliatywnym leczeniu raka przełyku i wpustu
- Leczenie skojarzone nowotworów przewodu pokarmowego
- Postępy w chirurgii przełyku w 2004 roku
Linki zewnętrzne
[edytuj | edytuj kod]- Zakład Brachyterapii COI w Warszawie – sposoby leczenia raka przełyku.. brachyterapia.coi.pl. [zarchiwizowane z tego adresu (2009-05-31)].
