Selenin sodu
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
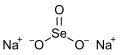
Na2SeO3 | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
172,94 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Wygląd |
kolor od białego do beżowego; słaby, charakterystyczny zapach | ||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS |
10102-18-8 (bezwodny) | ||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||||||||||||||||||
| Inne kationy | |||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
Selenin sodu – nieorganiczny związek chemiczny, sól sodowa kwasu selenawego. Występuje jako odmiana bezwodna lub pentahydrat (Na2SeO3·5 H2O).
Właściwości[edytuj | edytuj kod]
Selenin sodu jest ciałem stałym barwy od białej do beżowej (bezwodny) lub bezbarwnym (pentahydrat). Ma właściwości higroskopijne.
Jest rozpuszczalny w wodzie. Wartość pH jego roztworów wodnych wynosi ok. 9 dla stężenia 50 mg/l[2].
Synteza[edytuj | edytuj kod]
Selenin sodu można otrzymać w reakcji stężonego kwasu selenawego z roztworem wodorotlenku sodu wolnego od węglanów[4]:
- H
2SeO
3 + 2NaOH → Na
2SeO
3 + 2H
2O
Po zatężeniu z roztworu krystalizuje sól pięciowodna Na
2SeO
3·5H
2O o czystości analitycznej. Podczas ogrzewania w 40 °C przechodzi w sól bezwodną[4].
Zastosowanie[edytuj | edytuj kod]
Selen jest niezbędnym mikroelementem dla człowieka[5], dlatego selenin sodu bywa stosowany jako suplement diety, także w odżywkach dla niemowląt[6]. Europejski Urząd ds. Bezpieczeństwa Żywności określił bezpieczny limit dzienny spożycia na 300 μg[7].
Selenin sodu jest też stosowany jako środek owadobójczy, z dawką skuteczną na poziomie 10mg/kg[8].
Toksyczność[edytuj | edytuj kod]
Substancja działa silnie drażniąco na błony śluzowe oczu i dróg oddechowych. Powoduje odoskrzelowe zapalenie płuc oraz obrzęk płuc. Działa toksycznie na wiele narządów: wątrobę, nerki, drogi moczowe, przewód pokarmowy, śledzionę, szpik kostny, serce oraz nerwy.
Ze względu na swoją toksyczność bywa wykorzystywany w próbach samobójczych[9].
Działanie na organizmy wodne[edytuj | edytuj kod]
Selenin sodu działa bardzo toksycznie na organizmy wodne.
Dawki śmiertelne dla niektórych organizmów:
- Danio pręgowany 24 mg/l/96 h
- Pstrąg tęczowy 8,1 mg/l/96 h
- Dafnia (rozwielitka) 7,9 g/l/48 h
- Glony 96,6 mg/l/72 h
Przypisy[edytuj | edytuj kod]
- ↑ Department of Chemistry, The University of Akron: Sodium selenite. [dostęp 2011-09-23]. (ang.).
- ↑ a b Sodium selenite, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 500120 [dostęp 2011-09-23] (niem. • ang.).
- ↑ Selenin sodu (nr 214485) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- ↑ a b F. Feher, Sodium Selenite, [w:] Georg Brauer (red.), Handbook of Preparative Inorganic Chemistry, New York • London: Academic Press, 1963, s. 431–432 (ang.).
- ↑ P. Kamble i inni, Selenium Intoxication with Selenite Broth Resulting in Acute Renal Failure and Severe Gastritis, „Saudi Journal of Kidney Diseases and Transplantation”, 20 (1), 2009, s. 106, PMID: 19112227 [dostęp 2023-11-12] (ang.).
- ↑ Meng-Jie He i inni, Selenium in infant formula milk, „Asia Pacific Journal of Clinical Nutrition”, 27 (2), 2018, DOI: 10.6133/apjcn.042017.12, PMID: 29384312 [dostęp 2023-11-15] (ang.).
- ↑ EFSA Panel on Additives and Products or Substances used in Animal Feed, Safety and efficacy of selenium compounds (E8) as feed additives for all animal species: sodium selenite, based on a dossier submitted by Retorte GmbH Selenium Chemicals and Metals, „EFSA Journal”, 14 (2), 2016, DOI: 10.2903/j.efsa.2016.4398 [dostęp 2023-11-15] (ang.).
- ↑ Sodium Selenite [online], omanchem.com [dostęp 2023-11-12].
- ↑ A. Gasmi i inni, Acute selenium poisoning, „Veterinary and Human Toxicology”, 39 (5), 1997, s. 304–308, ISSN 0145-6296, PMID: 9311090.
Bibliografia[edytuj | edytuj kod]
- Witold Mizerski: Tablice chemiczne. Warszawa: wydawnictwo Adamantan, 2004.