Destylacja
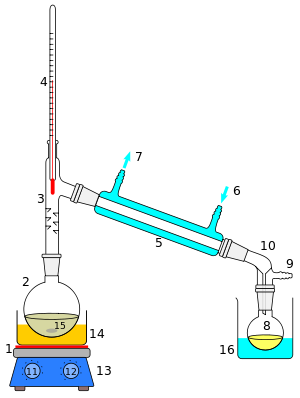

Destylacja (łac. destilatio, de- 'od' i stillare 'skraplanie' od stilla 'kropla') – rozdzielanie ciekłej mieszaniny wieloskładnikowej poprzez odparowanie, a następnie skroplenie jej składników. Stosuje się ją w celu wyizolowania lub oczyszczenia jednego lub więcej związków składowych. Proces wykorzystuje różną lotność względną składników mieszaniny.
Główny produkt destylacji (czyli skroplona ciecz) nazywany jest destylatem. Pozostałość po destylacji nazywana jest cieczą wyczerpaną.
Najważniejszymi urządzeniami zwiększającymi efektywność destylacji są: kolumna rektyfikacyjna (kolumna destylacyjna) i deflegmator (który jest również rodzajem kolumny rektyfikacyjnej, o specyficznej konstrukcji i zastosowaniu).
Rodzaje destylacji[edytuj | edytuj kod]
Poniżej wymieniono najważniejsze[1]:
- destylacja prosta (inaczej różniczkowa) – polega na jednorazowym odparowaniu i skropleniu cieczy
- destylacja równowagowa (inaczej rzutowa) – opary pozostają w kontakcie z wrzącą cieczą w stanie równowagi fizykochemicznej
- destylacja wielostopniowa – seria destylacji prostych prowadzonych jedna po drugiej
- rektyfikacja (inaczej destylacja frakcyjna) – proces kaskadowy w aparaturze, która umożliwia jednoczesne wielokrotne odparowywanie i skraplanie cieczy. Istotą jest przeciwprądowy ruch fazy ciekłej i gazowej; destylat może być odbierany w formie frakcji różniących się składem.
- destylacja azeotropowa – przy użyciu dodatkowego składnika (czynnika rozdzielającego), tworzącego azeotropy ze składnikiem lub składnikami mieszanin, wykorzystywana do rozdzielania azeotropów i składników bliskowrzących
- destylacja zeotropowa – przy użyciu czynnika rozdzielającego o dużej lotności, który nie tworzy azeotropów ze składnikami mieszanin, a zwiększa różnicę między ich względnymi prężnościami par, i jest odprowadzany z urządzenia destylacyjnego wraz ze składnikiem lub składnikami bardziej lotnymi
- destylacja ekstrakcyjna – przy użyciu czynnika rozdzielającego o małej lotności, który zwiększa różnicę między względnymi prężnościami par składników rozdzielanych mieszanin a jest odprowadzany z urządzenia destylacyjnego wraz ze składnikiem lub składnikami mniej lotnymi (z cieczą wyczerpaną)
- destylacja z parą wodną – stosowana często w preparatyce organicznej. Przez mieszaninę przepuszcza się parę wodną, obniża się temperaturę destylacji, a w odbieralniku otrzymujemy mieszaninę cieczy organicznej i wody[2].
- destylacja pod zmniejszonym ciśnieniem (inaczej próżniowa) – przy niższym ciśnieniu niższa jest też temperatura wrzenia, co zapobiega rozkładowi cieczy wrażliwych na wysokie temperatury
- destylacja cząsteczkowa (inaczej molekularna) - przebiega bez wrzenia (cząsteczki cieczy odrywają się od jej powierzchni dzięki ruchom termicznym) i pod bardzo niskim ciśnieniem; stosowana jest w przypadku cieczy wyjątkowo wrażliwych na wysokie temperatury, na przykład w farmaceutyce do produkcji koncentratów witaminowych.
- destylacja reaktywna – proces łączący w jednym urządzeniu równowagową reakcję chemiczną z oddzieleniem produktów za pomocą destylacji[3][4].
Warunki powodzenia destylacji[edytuj | edytuj kod]
Aby destylacja była skuteczna, skład gazu musi być różny od składu cieczy. Podstawowym warunkiem jest tu różnica temperatur wrzenia rozdzielanych związków chemicznych. Istnieją mieszaniny, których składników nie można rozdzielić przez „zwykłą” destylację, gdyż ciecze składowe podczas wrzenia wykazują identyczną prężność pary. Są to mieszaniny azeotropowe.
Mieszaniny azeotropowe można rozdzielić metodą destylacji azeotropowej, która polega na rozdestylowaniu ich po uprzednim wprowadzeniu dodatkowego składnika, tzw. czynnika azeotropującego, który tworzy z substancjami azeotrop trójskładnikowy, wrzący w innej temperaturze i z innym stosunkiem składników niż mieszanina wyjściowa. Przykładem może być azeotrop etanol-woda (95,57% etanolu, temperatura wrzenia czystego etanolu 78,3 °C), który można rozdzielić po dodaniu pewnej ilości benzenu. Powstaje wówczas trójskładnikowa mieszanina azeotropowa – o składzie 7,5% wody, 18,5% etanolu, 74% benzenu – mająca temperaturę wrzenia 68,86 °C. Po całkowitym oddestylowaniu takiej mieszaniny pozostałością jest alkohol bezwodny (absolutny). Metoda ta była stosowana w przemyśle spirytusowym, obecnie nie jest ona stosowana ze względu na toksyczność benzenu.
Analogiczne metody rozdziału[edytuj | edytuj kod]
Rozdziału mieszanin z wykorzystaniem różnic temperatur przemian fazowych składników można również dokonać przez:
- wymrażanie frakcyjne
- rekrystalizację frakcyjną
- sublimację i resublimację
- pirolizę z rozdziałem gazów.
Przypisy[edytuj | edytuj kod]
- ↑ Zespół redaktorów Działu Słownictwa Technicznego WNT: Leksykon naukowo–techniczny z suplementem. Wyd. 4. T. A–O. Warszawa: Wydawnictwo Naukowo–Techniczne, 1989. ISBN 83-204-0967-5. (pol.).
- ↑ Krzysztof Pigoń, Zdzisław Ruziewicz: Chemia fizyczna 1. Wyd. 6. Warszawa: Wydawnictwo Naukowe PWN, styczeń 2007. ISBN 978-83-01-15054-9.
- ↑ Jan Hehlmann, Maksymilian Gądek, Destylacja reaktywna – stosowane modele procesowe i rozwiązania aparaturowe, „Inżynieria i Aparatura Chemiczna”, 48 (3), 2009, s. 138-145 [dostęp 2019-04-30].
- ↑ Jan Hehlmann, Marcin Sobecki, Maksymilian Gądek, Oczyszczanie ścieków technologicznych z kwasu octowego metodą destylacji reaktywnej - modelowanie kinetyki reakcji estryfikacji, „Rocznik Ochrona Środowiska”, 13, 2011, s. 859-874 [dostęp 2019-04-30].
Bibliografia[edytuj | edytuj kod]
- Praca zbiorowa: Chemia. Małgorzata Wiśniewska (red.). Warszawa: Wydawnictwa Naukowo-Techniczne, 2001, seria: Encyklopedia dla Wszystkich. ISBN 83-204-2590-5.
