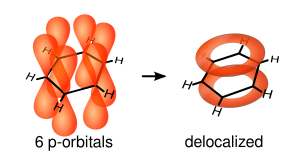Benzen
| |||||||||||||||||||||||||||||||||||||
 benzen w postaci stałej | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C6H6 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
78,11 g/mol | ||||||||||||||||||||||||||||||||||||
| Wygląd |
przezroczysta[2], bezbarwna ciecz o charakterystycznym zapachu[3] | ||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||
| Podobne związki |
naftalen, antracen, naftacen, pentacen, pirydyna, borazyna, benzen Dewara | ||||||||||||||||||||||||||||||||||||
| Pochodne aromatyczne | |||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||
Benzen – organiczny związek chemiczny z grupy arenów. Jest to najprostszy karbocykliczny, obojętny węglowodór aromatyczny. Jego nieorganicznym analogiem jest borazyna.
Budowa cząsteczki[edytuj | edytuj kod]
Struktura Kekulégo[edytuj | edytuj kod]
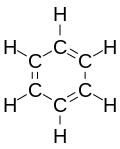
Problem budowy benzenu interesował chemików już od chwili wyodrębnienia tego związku. W 1865 r. niemiecki chemik Friedrich August Kekulé wysunął hipotezę, że benzen jest cykloheksatrienem o sześcioczłonowym pierścieniu, w którym pomiędzy atomami węgla na przemian występują wiązania pojedyncze i podwójne[13]:
Teoria rezonansu chemicznego[edytuj | edytuj kod]
Struktura Kekulégo nie tłumaczyła jednak dlaczego benzen i inne związki aromatyczne nie posiadają właściwości charakterystycznych dla węglowodorów nienasyconych, mimo 6 elektronów π w pierścieniu (sekstet elektronowy)[3]. Ponadto w miarę gromadzenia się materiału eksperymentalnego okazywało się, że wszystkie wiązania C−C w pierścieniu benzenowym są równocenne. Na podstawie badań spektroskopowych ustalono, że cząsteczka benzenu w istocie stanowi pierścień złożony z sześciu atomów węgla połączonych równocennymi wiązaniami o długości 1,39 Å, czyli pośredniej pomiędzy długością wiązania pojedynczego (1,54 Å) i podwójnego (1,34 Å). Struktury uśrednionej nie można zobrazować klasycznymi wiązaniami pojedynczymi i podwójnymi, można jednak przedstawić graniczne struktury rezonansowe:
Mechanika kwantowa[edytuj | edytuj kod]
Zagadnienie płaskiej budowy pierścienia benzenowego dobrze tłumaczy kwantowomechaniczna metoda orbitali molekularnych. Przyjmuje się hybrydyzację sp² (kąty pomiędzy wiązaniami H−C−C i C−C−C wynoszą 120°) dla atomów węgla[3]. Zhybrydyzowane orbitale tworzą wiązania σ C−C i C−H. Pozostałe orbitale p atomów węgla (o osiach prostopadłych do płaszczyzny cząsteczki) tworzą zdelokalizowane wiązania π. W efekcie 6 elektronów π nie jest przypisane ani do żadnego z atomów węgla, ani do żadnego wiązania węgiel-węgiel, lecz znajduje się w dwóch chmurach nad i pod płaszczyzną pierścienia, których kształt jest zbliżony do torusa[14][15]:
Otrzymywanie[edytuj | edytuj kod]
Skala laboratoryjna[edytuj | edytuj kod]
- odwodornianie cykloheksanu w temp. 300 °C na katalizatorze (najczęściej platyna osadzona na tlenku glinu)[potrzebny przypis]

- trimeryzacja acetylenu poprzez ogrzewanie go w obecności węgla aktywnego:
- 3C
2H
2 → C
6H
6
Skala przemysłowa[edytuj | edytuj kod]
Do czasów II wojny światowej główną metodą otrzymywania benzenu była ekstrakcja ze smoły pogazowej[3] (produkt uboczny w przemyśle koksowniczym i gazowniczym). W latach 50. XX wieku wzrosło zapotrzebowanie na benzen, głównie ze strony przemysłu tworzyw sztucznych i konieczna stała się jego produkcja na wielką skalę z ropy naftowej[3].
Obecnie, oprócz ekstrakcji ze smoły pogazowej, stosuje się następujące metody otrzymywania benzenu:
- piroliza lekkich frakcji ropy naftowej z parą wodną (kraking parowy)
- reforming lekkich frakcji ropy naftowej
- dealkilacja toluenu, polegająca na przepuszczaniu mieszaniny toluenu i wodoru nad katalizatorem (chrom, molibden lub tlenek platyny) w temperaturze 500–600 °C pod ciśnieniem 40–60 atmosfer (czasem zamiast katalizatora używa się wyższych temperatur):
- C
6H
5CH
3 + H
2 → C
6H
6 + CH
4
Właściwości[edytuj | edytuj kod]
Właściwości fizyczne[edytuj | edytuj kod]
W temperaturze pokojowej benzen jest bezbarwną cieczą o charakterystycznym, ostrym zapachu. Bardzo słabo rozpuszcza się w wodzie, natomiast lepiej w rozpuszczalnikach organicznych[3]. Sam jest dobrym rozpuszczalnikiem dla wosków, tłuszczów, naftalenu i innych niepolarnych związków chemicznych.
Właściwości chemiczne[edytuj | edytuj kod]
Pali się kopcącym płomieniem, a jego ciepło spalania wynosi 9470 kcal/kg.
Benzen jest związkiem trwałym chemicznie, w przeciwieństwie do alkenów nie ulega łatwo reakcji addycji. Stosunkowo łatwo natomiast zachodzi substytucja elektrofilowa do pierścienia aromatycznego. Przykładem może być reakcja alkilowania i acylowania, katalizowana kwasami Lewisa, nazywana reakcją Friedla-Craftsa.
Właściwości biologiczne[edytuj | edytuj kod]
W większych ilościach benzen jest toksyczny. LD50 (szczur, doustnie) wynosi 930 mg/kg, LC50 (szczur, inhalacja) – 10 000 ppm przez 7 h. Ma silne właściwości rakotwórcze. Po spożyciu powoduje podrażnienie śluzówki żołądka, mdłości i wymioty. Przy pochłonięciu większych ilości powoduje bóle głowy, drgawki i zgon.
Zastosowanie[edytuj | edytuj kod]
Benzen jest jednym z najważniejszych rozpuszczalników, jak i substratów wielu związków w syntezie organicznej, służy m.in. do produkcji tworzyw sztucznych, włókien syntetycznych, barwników, leków, detergentów, pestycydów[3], a także do otrzymywania aniliny, fenolu i acetonu (metoda kumenowa) oraz bezwodnika maleinowego.
Sam benzen jest ze względu na swoje właściwości toksyczne i rakotwórcze rzadko używany. Był niegdyś masowo stosowany jako rozpuszczalnik dla wielu reakcji prowadzonych w skali przemysłowej – obecnie jednak zastępuje się go innymi rozpuszczalnikami, o ile tylko istnieje taka możliwość.
Historia[edytuj | edytuj kod]
Benzen został po raz pierwszy wyodrębniony przez Michaela Faradaya w 1825 r. ze sprężonego gazu świetlnego będącego oleistą pozostałością zbierającą się na dnie londyńskich gazowych lamp ulicznych. W 1845 inny angielski chemik, Charles Mansfield, pracując pod kierunkiem Augusta Wilhelma von Hofmanna, wyodrębnił go ze smoły węglowej. Cztery lata później Mansfield rozpoczął produkcję benzenu na skalę przemysłową bazując na tej metodzie. Nazwę „benzen” (benzol) zaproponował w 1843 r. niemiecki chemik Justus von Liebig.
Zagrożenia[edytuj | edytuj kod]
Benzen podejrzewany o toksyczność był już w 1900 roku. Powoduje on zarówno ostre, jak i przewlekłe zatrucia. Zazwyczaj do zatrucia dochodzi poprzez wdychanie par przez układ oddechowy, jednak możliwa jest również absorpcja przez skórę i wchłanianie wraz z pokarmem. Około 6,4 g/m³ powoduje ostre zatrucie w ciągu godziny inhalacji, zaś dawka 10-krotnie większa powoduje natychmiastowy zgon.
Ostre zatrucie benzenem charakteryzuje się podrażnieniem skóry, rumieniem, odczuciem palenia. Benzen oddziałuje na ośrodkowy układ nerwowy powodując senność, bóle i zawroty głowy, utratę przytomności, niewydolność układu oddechowego, a w rezultacie zgon[16]. Charakterystycznymi objawami są też: krwawienia z błon śluzowych, szybki i płytki oddech, drżenie kończyn, zaburzenia rytmu serca[16]. Przy zatruciu drogą pokarmową dołączają się także wymioty i drgawki[16].
Dużo częstsze są zatrucia przewlekłe. Pierwsze objawy są niespecyficzne, są to zmęczenie, ból głowy, utrata apetytu. Dokładniejsze badania wykazują nieprawidłowości w składzie biochemicznym krwi. Najczęściej dochodzi do obniżenia liczby białych ciałek krwi co powoduje spadek odporności i płytek krwi. Benzen również działa niszcząco na szpik kostny i może powodować białaczkę lub szpiczaka mnogiego[17]. Pary benzenu po dostaniu się do płuc absorbowane są przez krew, z której w dużym stopniu wchłaniane są przez tkanki tłuszczowe.
Niemetabolizowany benzen wydalany jest przez płuca. Metabolizm benzenu zachodzi przede wszystkim w wątrobie. Najpierw benzen ulega utlenieniu w wyniku działania enzymów cytochromu P-450 do oksepiny, która jest utrzymywana w stanie równowagi dynamicznej z epoksybenzenem. Epoksybenzen może ulec uwodnieniu w wyniku działania enzymu hydrolazy epoksydowej dając benzeno-trans-dihydro-1,2-diol, następnie związek ten pod wpływem enzymu dehydrogenazy dihydrodiolowej przekształcany jest w katechol. Oksepina może również reagować poprzez otwarcie pierścienia, dając jako produkt aldehyd (E,E)-mukonowy i kwas (E,E)-mukonowy.
Niektóre metabolity są odpowiedzialne za działanie toksyczne benzenu. Na przykład główne działanie rakotwórcze wykazują kwasy mukonowe powstające jako metabolity.

- Ogólny schemat metabolizmu benzenu[18]
Uwagi[edytuj | edytuj kod]
- ↑ Nazwa nie odzwierciedla rzeczywistego układu wiązań w cząsteczce. Patrz sekcja „Budowa cząsteczki”.
Przypisy[edytuj | edytuj kod]
- ↑ a b Henri A. Favre, Warren H. Powell, Nomenklatura związków organicznych. Rekomendacje IUPAC i nazwy preferowane 2013, Komisja Terminologii Chemicznej Polskiego Towarzystwa Chemicznego (tłum.), wyd. 3, Narodowy Komitet Międzynarodowej Unii Chemii Czystej i Stosowanej, [2017], s. 131.
- ↑ Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b c d e f g Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 51, ISBN 83-7183-240-0.
- ↑ a b c d e Haynes 2016 ↓, s. 3-34.
- ↑ Haynes 2016 ↓, s. 5-173.
- ↑ a b c Haynes 2016 ↓, s. 5-140.
- ↑ a b c Haynes 2016 ↓, s. 6-67.
- ↑ Haynes 2016 ↓, s. 6-243.
- ↑ Haynes 2016 ↓, s. 6-190.
- ↑ a b c d e Haynes 2016 ↓, s. 15-13.
- ↑ Benzen, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2020-05-11] (ang.).
- ↑ a b Benzen (nr 270709) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2020-05-11]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ August Kekulé, Untersuchungen über aromatische Verbindungen Ueber die Constitution der aromatischen Verbindungen. I. Ueber die Constitution der aromatischen Verbindungen, „Liebigs Annalen”, 137 (2), 1865, s. 129–196, DOI: 10.1002/jlac.18661370202 (niem.).
- ↑ The Bonding in Benzene, [w:] Paula Yurkanis Bruice, Organic chemistry, Prentice Hall, 2003, s. 267, ISBN 978-0-13-140748-0.
- ↑ Orbitale w cząsteczce benzenu, [w:] Robert T. Morrison, Robert N. Boyd, Chemia organiczna, t. 1, Warszawa: Państwowe Wydawnictwo Naukowe, 1985, s. 388–389, ISBN 83-01-04166-8.
- ↑ a b c Facts About Benzene, [w:] Emergency Preparedness and Response [online], Centers for Disease Control and Prevention [dostęp 2017-07-21] (ang.).
- ↑ A. Yardley-Jones, D. Anderson, D.V. Parke, The toxicity of benzene and its metabolism and molecular pathology in human risk assessment, „British Journal of Industrial Medicine”, 48 (7), 1991, s. 437–444, PMID: 1854646, PMCID: PMC1035396.
- ↑ Stephen M. Rappaport i inni, Evidence That Humans Metabolize Benzene via Two Pathways, „Environmental Health Perspectives”, 117 (6), 2009, s. 946–952, DOI: 10.1289/ehp.0800510, PMID: 19590688, PMCID: PMC2702411.
Bibliografia[edytuj | edytuj kod]
- CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, ISBN 978-1-4987-5429-3 (ang.).
- S.E. Manahan, Toksykologia środowiska. Aspekty chemiczne i biologiczne, Warszawa: Wydawnictwo Naukowe PWN, 2006, ISBN 83-01-14841-1.