Palladyna
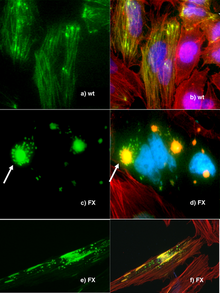
Palladyna – białko cytoszkieletu komórki, u człowieka kodowane przez gen PALLD w locus 4q31.3[1]. Białko zostało zidentyfikowane przez dwie niezależnie działające grupy badawcze, jedną z laboratorium Carola Oteya (w 2000)[2] i drugą z laboratorium Olliego Carpéna (w 2001)[3]. Należy do rodziny miotyliny-miopalladyny-palladyny i może odgrywać rolę w modulacji cytoszkieletu aktynowego[4]. W odróżnieniu od miotyliny i miopalladyny, podlegających ekspresji jedynie w mięśniach poprzecznie prążkowanych, gen palladyny przepisywany jest na białko we wszystkich komórkach mezenchymalnych. Nazwa palladyny pochodzi od architekta renesansowego Andrei Palladio[2].
Izoformy[edytuj | edytuj kod]
U ludzi istnieje siedem izoform palladyny, z których niektóre powstają jako wynik alternatywnego splicingu[5]. U myszy jeden gen przepisywany jest na trzy izoformy białka. Zawierają one od trzech do pięciu domen immunoglobulinopodobnych i jedną lub dwie domeny poliprolinowe.
Funkcja[edytuj | edytuj kod]

Dokładna biologiczna funkcja palladyny w komórce nie jest dokładnie wyjaśniona, jednak wykazano, że odgrywa ona rolę w organizacji cytoszkieletu, rozwoju zarodkowym, ruchliwości komórek, tworzeniu blizn skóry i rozwoju neuronów.
Rola w patologii[edytuj | edytuj kod]

RNA palladyny ulega nadmiernej ekspresji u pacjentów z rakiem trzustki. U części pacjentów z rodzinnym rakiem tego narządu gen palladyny jest dodatkowo zmutowany[6]. Do roku 2007 mutacje palladyny u pacjentów z rodzinnym rakiem trzustki stwierdzono jednak jedynie u jednej północnoamerykańskiej rodziny, tej samej mutacji nie wykazano w dwóch innych badaniach u żadnej z rodzin z rodzinnym rakiem trzustki, zarówno w Europie, jak i Ameryce Północnej[7][8].
Salaria i wsp. dowiedli, że palladyna ulega nadmiernej ekspresji w nienowotworowym podścielisku raka trzustki, natomiast rzadko w komórkach nowotworowych per se; sugeruje to, że rola palladyny w patogenezie nowotworu może mieć związek ze zmianami w mikrośrodowisku komórek guza[9].
Mutacje powodujące choroby stwierdzono też w genach dwóch pozostałych białek rodziny palladyny; mutacje miotyliny związane są z jedną z postaci dystrofii obręczowo-kończynowej (1A)[10] oraz rzadkim typem dystrofii mięśniowej[11], a mutacje miopalladyny związane są z jedną z postaci kardiomiopatii rozstrzeniowej[12].
Przypisy[edytuj | edytuj kod]
- ↑ Bang ML, Mudry RE, McElhinny AS, Trombitás K, Geach AJ, Yamasaki R, Sorimachi H, Granzier H, Gregorio CC, Labeit S. Myopalladin, a novel 145-kilodalton sarcomeric protein with multiple roles in Z-disc and I-band protein assemblies. „The Journal of Cell Biology”. 2 (153), s. 413–427, 2001. DOI: 10.1083/jcb.153.2.413. PMID: 11309420. PMCID: PMC2169455.
- ↑ a b Parast MM, Otey CA. Characterization of palladin, a novel protein localized to stress fibers and cell adhesions. „The Journal of Cell Biology”. 3 (150), s. 643–656, 2000. DOI: 10.1083/jcb.150.3.643. PMID: 10931874. PMCID: PMC2175193.
- ↑ Mykkänen OM, Grönholm M, Rönty M, Lalowski M, Salmikangas P, Suila H, Carpén O. Characterization of human palladin, a microfilament-associated protein. „Molecular Biology of the Cell”. 10 (12), s. 3060–3073, 2001. DOI: 10.1091/mbc.12.10.3060. PMID: 11598191. PMCID: PMC60155.
- ↑ Otey CA, Rachlin A, Moza M, Arneman D, Carpen O. The palladin/myotilin/myopalladin family of actin-associated scaffolds. „International Review of Cytology”, s. 31–58, 2005. DOI: 10.1016/S0074-7696(05)46002-7. PMID: 16164966.
- ↑ Rachlin AS, Otey CA. Identification of palladin isoforms and characterization of an isoform-specific interaction between Lasp-1 and palladin. „Journal of Cell Science”. Pt 6 (119), s. 995–1004, 2006. DOI: 10.1242/jcs.02825. PMID: 16492705.
- ↑ Pogue-Geile KL, Chen R, Bronner MP, Crnogorac-Jurcevic T, Moyes KW, Dowen S, Otey CA, Crispin DA, George RD, Whitcomb DC, Brentnall TA. Palladin mutation causes familial pancreatic cancer and suggests a new cancer mechanism. „PLoS Medicine”. 12 (3), s. e516, 2006. DOI: 10.1371/journal.pmed.0030516. PMID: 17194196. PMCID: PMC1751121.
- ↑ Slater E, Amrillaeva V, Fendrich V, Bartsch D, Earl J, Vitone LJ, Neoptolemos JP, Greenhalf W. Palladin mutation causes familial pancreatic cancer: absence in European families. „PLoS Medicine”. 4 (4), s. e164, 2007. DOI: 10.1371/journal.pmed.0040164. PMID: 17455999. PMCID: PMC1855695.
- ↑ Zogopoulos G, Rothenmund H, Eppel A, Ash C, Akbari MR, Hedley D, Narod SA, Gallinger S. The P239S palladin variant does not account for a significant fraction of hereditary or early onset pancreas cancer. „Human Genetics”. 5 (121), s. 635–637, 2007. DOI: 10.1007/s00439-007-0361-z. PMID: 17415588.
- ↑ Salaria SN, Illei P, Sharma R, Walter KM, Klein AP, Eshleman JR, Maitra A, Schulick R, Winter J, Ouellette MM, Goggins M, Hruban R. Palladin is overexpressed in the non-neoplastic stroma of infiltrating ductal adenocarcinomas of the pancreas, but is only rarely overexpressed in neoplastic cells. „Cancer Biology & Therapy”. 3 (6), s. 324–328, 2007. DOI: 10.4161/cbt.6.3.3904. PMID: 17404500. PMCID: PMC3144721.
- ↑ Hauser MA, Horrigan SK, Salmikangas P, Torian UM, Viles KD, Dancel R, Tim RW, Taivainen A, Bartoloni L, Gilchrist JM, Stajich JM, Gaskell PC, Gilbert JR, Vance JM, Pericak-Vance MA, Carpen O, Westbrook CA, Speer MC. Myotilin is mutated in limb girdle muscular dystrophy 1A. „Human Molecular Genetics”. 14 (9), s. 2141–2147, 2000. DOI: 10.1093/hmg/9.14.2141. PMID: 10958653.
- ↑ Selcen D, Engel AG. Mutations in myotilin cause myofibrillar myopathy. „Neurology”. 8 (62), s. 1363–1371, 2004. DOI: 10.1212/01.WNL.0000123576.74801.75. PMID: 15111675.
- ↑ Duboscq-Bidot L, Xu P, Charron P, Neyroud N, Dilanian G, Millaire A, Bors V, Komajda M, Villard E. Mutations in the Z-band protein myopalladin gene and idiopathic dilated cardiomyopathy. „Cardiovascular Research”. 1 (77), s. 118–125, 2008. DOI: 10.1093/cvr/cvm015. PMID: 18006477.
