Bielczyk (ptak): Różnice pomiędzy wersjami
Nowy artykuł. |
(Brak różnic)
|
Wersja z 19:33, 1 paź 2013
| Leucochloris albicollis[1] | |
| (Vieillot, 1818) | |
 Osobnik sfotografowany w Brazylii | |
| Systematyka | |
| Domena | |
|---|---|
| Królestwo | |
| Typ | |
| Podtyp | |
| Gromada | |
| Podgromada | |
| Nadrząd | |
| Rząd | |
| Rodzina | |
| Podrodzina | |
| Rodzaj |
Leucochloris |
| Gatunek |
bielczyk |
| Kategoria zagrożenia (CKGZ)[2] | |
 | |
| Zasięg występowania | |
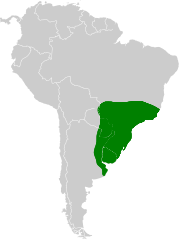
| |
Bielczyk (Leucochloris albicollis) – gatunek małego ptaka z rodziny kolibrowatych. Jedyny przedstawiciel rodzaju Leucochloris. Występuje w Ameryce Południowej. Niezagrożony wyginięciem.
Taksonomia
Po raz pierwszy opis bielczyka ukazał się w roku 1818, jego autorem był Louis Jean Pierre Vieillot. Opisany został w dziele Nouveau dictionnaire d'histoire naturelle pod hasłem Oiseau-mouche, jako Oiseau-mouche a gorge blanche (fr. koliber z białym gardłem). Otrzymał nazwę naukową Trochilus albicollis. Holotyp pochodził z Brazylii, lecz nie podano dokładnej lokacji; został przekazany do zbiorów Muzeum Historii Naturalnej w Paryżu[3].
Do monotypowego rodzaju Leucochloris wydzielił bielczyka Heinrich Gottlieb Ludwig Reichenbach w roku 1954, otrzymał nazwę naukową Leucochloris albicollis[4]. Według IOC gatunek należy do tego właśnie monotypowego rodzaju; nie wydziela się podgatunków[5].
- Etymologia nazwy naukowej
Nazwa rodzajowa Leocochloris pochodzi od dwóch greckich słów — leucos, czyli biały, oraz khlōros (zielony). Nazwa gatunkowa albicollis oznacza z łaciny białoszyi[6]. John Gould odnotował, że lokalna nazwa na południu Brazylii brzmi Papa branca[7].
- Mieszańce międzygatunkowe
Jednokrotnie odnotowano osobnika, który najprawdopodobniej był hybrydą bielczyka ze złocikiem złotobrzuchym (Chlorostilbon aureoventris)[8].
Morfologia
W pierwszym opisie podano przybliżoną długość ciała 3¾ cala (ok. 9,5 cm)[3]. Dla dziesięciu zbadanych osobników, zebranych w Brazylii, wymiary są następujące: całkowita długość ciała 108,5-113,5 mm (większa, niż w 1. opisie), skrzydło 59,5-62 mm, ogon 31,5-35 mm, dziób 21-21,5 mm, zaś skok 4-4,5 mm[9]. Całkowita powierzchnia skrzydeł wynosi 25,6 cm², masa ciała zaś około 6 gramów[10] dla samca, dla samicy 4,5 g[11].
Dziób prosty, dłuższy od głowy, szeroki u nasady. Pióra na czole nachodzą na nozdrza, zasłaniając je. Skrzydła długie, sięgają końca ogona. Ogon gdy złożony zaokrąglony. Dymorfizm płciowy niewyraźny[12].
U samca wierzch ciała zielony, złoto połyskujący. Środkowe sterówki brązowozielone, zewnętrzne zaś czarnoniebieskie z białymi zakończeniami. Najbardziej zewnętrzna sterówka do połowy czarnoniebieska, od połowy biała. Broda, pierś i boki zielone, połyskujące. Gardło, brzuch oraz pokrywy podogonowe czystobiałe. Skrzydła purpurowobrązowe. Lotki drugorzędowe występują w liczbie siedmiu[13]. Górna połowa dzioba czarna, dolna natomiast z początku różowa, następnie czarna. Samicę cechują jedynie nieznacznie mniejsze niż u samca wymiary[12].
Zasięg występowania
Całkowity zasięg występowania szacowany jest na 2 180 000 km²[14]. Na północny swego zasięgu bielczyk spotykany jest w stanie Espirito Santo w lasach typu Mata Atlantica[15], a także w Minas Gerais[16]. Występuje także na wyspie Santa Catarina[17]. Południowa granica zasięgu występowania znajduje się w okolicach Mar del Plata w Argentynie[14], gdzie jest spotykany mimo postępującej urbanizacji regionu[18]. Prócz tego bielczyk zasiedla Urugwaj oraz wschodnią połowę Paragwaju[14]. Maksymalna wysokość, na jakiej jest spotykany, to 2400 m n.p.m[19].
Behawior
U tego gatunku występuje torpor. W trakcie niego temperatura ciała spada do 12-18°C[20]. W locie 32 uderzenia skrzydeł na sekundę[10].
Pożywienie
Żywi się nektarem z kwiatów wielu gatunków roślin. Wśród brazylijskich można wymienić Myrsine coriacea (Myrsinaceae)[21], Hippeastrum atibaya (amarylkowate), Siphocampylus sulfureus i Siphocampylus umbellatus (kaktusowate), Mabea fistulifera (wilczomleczowate), Stenorrhynchos lanceolatus (storczykowate) oraz Esterhazya macrodonta (trędnikowate)[22].
Przenosząc pyłki kwiatowe bierze udział w zapylaniu. Wiadome jest, że zapyla m.in. następujące cztery gatunki roślin: Hippeastrum glaucescens (amarylkowate), Agarista hispidula (wrzosowate), Sinningia allagophyla (ostrojowate) oraz Esterhazya macrodonta (zarazowate)[23]. Dane dotyczące wyglądu zapylanych roślin przedstawia tabela[23]:
| Roślina | Kształt kwiatu | Barwa kwiatu |
|---|---|---|
| Hippeastrum glaucescens | w kształcie tuby | ciemnoczerwony |
| Agarista hispidula | w kształcie tuby | czerwony |
| Sinningia allagophyla | w kształcie tuby | pomarańczowoczerwony |
| Esterhazya macrodonta | w kształcie tuby | pomarańczowoczerwony |
Kwiaty koralodrzewi (Erythrina spp.), których nektarem także się żywi, również są czerwone do pomarańczowych[24]. Ornitogamia ze strony bielczyka ma miejsce również na kwiatach Tropaeolum pentaphyllum. Posiadają one czerwone ostrogi. Ich nektar zawiera 27-63% cukru[25]. U badanych przedstawicielu ostrojowatych, na których żerowały Leucochloris albicollis, zawartość cukru w nektarze wynosiła 13,3-34,5%[26].
Lęgi
Okres lęgowy trwa od listopada do marca[27].
Gniazdo ma kształt kubeczka. Na zewnętrzną jego część składa się mech połączony pajęczyną. Warstwa wewnętrzna składa się z puchu roślinnego, włókien roślinnych o barwie pomarańczowoczerwonej oraz płowej, niekiedy również puchu ptasiego. Przeważnie znajduje się w rozwidleniu gałęzi krzewu[7]. Jego średnica wynosi około 5 cm, głębokość 18 mm, zaś grubość ścianek bocznych 1 cm[28].
Jajo ma wymiary około 13-16x8,6-10 mm. Jego masa wynosi około 0,7 grama[29]. Składane w liczbie dwóch. Barwa śnieżnobiała[7].
Samica wysiaduje jaja sama przez 14 dni. Młode opuszczają gniazdo 25 dni po wykluciu[27].
Pasożyty
Na podstawie okazów odnalezionych w upierzeniu bielczyka opisany nowy gatunek roztocza, Rhamphoeaulus sinuatus[30].
Status zagrożenia

Bielczyk klasyfikowany jest przez IUCN jako gatunek najmniejszej troski (LC, Least Concern). Nie jest znana liczebność populacji ani jej trend, jednak gatunek określany jako "pospolity", co w połączeniu z bardzo dużym zasięgiem występowania nie budzi wątpliwości co do przetrwania gatunku[14].
Zasiedla 22 obszary sklasyfikowane jako Important Bird Area[14]. Prócz tego spotykany w Parku Narodowym Serra do Cipó[16]. Wymieniony jest w załączniku II CITES (obejmuje on wszystkie kolibry), prócz tego w Rozporządzeniu Rady (WE) Nr 338/97 z dnia 9 grudnia 1996 r[31].
Relacje z ludźmi
John Gould, w swym dziele A monograph on the Trochilidae wspominał, że od czasu do czasu skórki tego ptaka są wysyłane do Europy (ten tom, należący do całej serii monografii, ukazał się w roku 1861)[7].
Średnica obrączki dla Leucochloris albicollis wynosi 6,5 mm[32].
- ↑ Leucochloris albicollis, [w:] Integrated Taxonomic Information System (ang.).
- ↑ Leucochloris albicollis, [w:] The IUCN Red List of Threatened Species (ang.).
- ↑ a b Nouveau dictionnaire d'histoire naturelle. T. 23. 1818, s. 426-427.
- ↑ H.G. Ludwig Reichenbach. Aufzählung der Colibris Oder Trochilideen in ihrer wahren natürlichen Verwandtschaft, nebst Schlüssel ihrer Synonymik. „Journal für Ornithologie”. 2, s. 10, 1854.
- ↑ F. Gill & D. Donsker: Swifts, hummingbirds & allies. IOC World Bird List (v3.5). [dostęp 30 września 2013].
- ↑ James A. Jobling: Helm Dictionary of Scientific Bird Names. Christopher Helm Publishers Ltd, 2009, s. 223 i 38. ISBN 1-4081-2501-3.
- ↑ a b c d John Gould: A monograph of the Trochilidæ, or family of humming-birds. T. 5. Taylor & Francis, 1861.
- ↑ Eugene M. McCarthy: Handbook of Avian Hybrids of the World. Oxford University Press, 2006. ISBN 978-0-19-804041-5.
- ↑ Graf von Berlepsch. Zur Ornitologie der Provinz Santa Catharina, Süd-Brasilien. . 21, s. 276, 1873.
- ↑ a b Crawford H. Greenewalt. Dimensional relationship for flying animals. „Smithsonian miscellaneous collections”. 144, s. 32, 1962.
- ↑ Josep del Hoyo, Andrew Elliott, Jordi Sargatal: Handbook of the Birds of the World. T. 5. Barn-owls to hummingbirds. Lynx Edicions, 1999. ISBN 978-84-87334-25-2.
- ↑ a b Adolphe Boucard: Genera of humming birds: being also a complete monograph of these birds. Londyn: 1895, s. 168.
- ↑ Hubert Lyman Clark. The Feather Tracts of Swifts and Hummingbirds. „The Auk”. 23, s. 82, 1906.
- ↑ a b c d e White-throated Hummingbird Leucochloris albicollis. BirdLife International. [dostęp 30 września 2013].
- ↑ Piero Angeli Ruschi & José Eduardo Simon. Hummingbirds of Santa Teresa, State of Espírito Santo, Southeastern Brazil. „Boletim do Museu de Biologia Mello Leitão”. 29, s. 31-52, 2012.
- ↑ a b Marcos Rodrigues, Guilherme H.S. Freitas, Lilian M. Costa, Daniel F. Dias, Mariane L. M. Varela & Licléia C. Rodrigues. Avifauna, Alto do Palácio, Serra do Cipó National Park, state of Minas Gerais, southeastern Brazil. „Check List”. 7 (2), 2011. ISSN 1809-127X.
- ↑ Luciano N. Naka, Marcos Rodrigues, Andrei l. Roos & Marcos A. G. Azevedo. Bird conservation on Santa Catarina Island, Southern Brazil. „Bird Conservation International”. 12, s. 23–150, 2002. BirdLife International.
- ↑ Lucas M. Leveau & Carlos M. Leveau. Comunidades de aves en un gradiente urbano de la ciudad de Mar del Plata, Argentina. „Hornero”. 19 (1), 2004. Asociación Ornitológica del Plata.
- ↑ E. Gounelle. Contribution à l'etudé de la distribution géographique des trochilidés dans le Brésil central et oriental. „Ornis”. 13 (3), s. 180, 1909. (fr.).
- ↑ Claus Bech, Augusto S. Abe, John Fleng Steffensen, Martin Berger & Jose Eduardo P. W. Bicudo. Torpor in Three Species of Brazilian Hummingbirds under Semi-Natural Conditions. „The Condor”. 99 (3), 1997.
- ↑ Aparecida Brusamarello Basler, Eliara Solange Müller & Maria Virginia Petry. Frugivory by birds in Myrsine coriacea (Myrsinaceae) inhabiting fragments of mixed Araucaria Forest in the Aparados da Serra National Park, RS, Brazil. „Revista Brasileira de Ornitologica”. 17 (2), 2009.
- ↑ Luciana Baza Mendonça & Luiz dos Anjos. Bird-flower interactions in Brazil: a review. „Ararajuba”. 11 (2), s. 195-205, 2003.
- ↑ a b Leandro Freitas & Marlies Sazima. Pollination Biology in a Tropical High-Altitude Grassland in Brazil: Interactions at the Community Level. „Annals of the Missouri Botanical Garden”. 93 (3), s. 465-516, 2006.
- ↑ Leonardo Galetto, Gabriel Bernardello, Irene C. Isele, Jose Vesprini, Gabriela Speroni & Alfredo Berduc. Reproductive Biology of Erythrina crista-galli (Fabaceae). „Annals of the Missouri Botanical Garden”. 87 (2), 2000.
- ↑ Liliana T. Fabbri, Juan J. Valla. Aspectos de la biología reproductiva de Tropaeolum pentaphyllum (Tropaeolaceae). „Darwiniana”. 36 (1), s. 51-58, 1998.
- ↑ Mathieu Perreta, Alain Chautemsa, Rodolphe Spichigera, Mauro Peixotob & Vincent Savolainen. Nectar Sugar Composition in Relation to Pollination Syndromes in Sinningieae (Gesneriaceae). „Annals of Botany”. 87 (2), s. 267–273, 2001.
- ↑ a b Rolf Grantsau: Die Kolibris Brasiliens. Expressão e Cultura, 1988, s. 97. ISBN 978-85-208-0101-7.
- ↑ Emilio Augusto Goeldi: As Aves do Brasil. T. 1. 1894, s. 226.
- ↑ Max Schönwetter & W. Meise: Handbuch der Oologie. T. 11. Berlin: 1966, s. 673.
- ↑ Chong K. Park & Warren T. Atyeo. A new subfamily and genus of feather mites from Hummingbirds (Acarina:Proctophyllodidae). „The Florida Entomologist”. 53 (3), 1971.
- ↑ World Conservation Monitoring Centre: Checklist of birds listed in the CITES appendices and in EC Regulation 338/97. 1999, s. 131.
- ↑ Yoshika Oniki. Band Sizes of Southeastern Brazilian Hummingbirds (Tamaño de Anillas Para Zumbadores Brazileños). „Journal of Field Ornithology”. 67 (3), 1996.
