Utlenianie Baeyera-Villigera: Różnice pomiędzy wersjami
tłumaczenie angielskiego artykułu |
(Brak różnic)
|
Wersja z 11:48, 19 kwi 2009
Utlenianie Baeyera-Villigera - reakcja chemiczna polegająca na utlenianiu ketonów do estrów za pomocą nadkwasów lub nadtlenku wodoru [1] [2]. Największą zaletą tej reakcji jest jej stereospecyficzność oraz regioselektywność [3]. Nazwa pochodzi od nazwisk odkrywców, chemików: Johanna Friedricha Wilhelma Adolfowa von Baeyera (1835-1917) niemieckiego pochodzenia oraz Victora Villigera (1868-1934) pochodzenia szwedzkiego.

Jako utleniacza używa się zwykle kwasu metanadchlorobenzoesowego (mCPBA), kwasu nadoctowego lub kwasu nadtrójfluorooctowego [4]. Cykliczne lub "naprężone" ketony takie jak cyklobutanon czy norbornanon reagują z nadtlenkiem wodoru i innymi nadtlenkami organicznymi, tworząc laktony. W opublikowanej przez odkrywców reakcji, jako utleniacza użyli oni, odkrytego zaledwie rok wcześniej, kwasu Caro [5]. Aby zapobiec hydrolizie i transestryfikacji dodaje się zwykle wodorowęglanu sodu lub wodorofosforanu sodu jako odczynnik tworzący roztwór buforowy.
Mechanizm
Cząsteczka nadkwasu przyłącza się do grupy karbonylowej, tworząc tetraedryczną strukturę przejściową. Etap ten jest podobny do reakcji Criegee'a. Według najnowszych teoretycznych rozważań, biorą w nim udział trzy cząsteczki nadkwasu oddziaływające ze sobą wiązaniami wodorowymi [6]. Kolejnym etapem jest skoordynowana migracja jednej z reszt alkilowych ketonu do atomu tlenu i odejście kwasu karboksylowego z zachowaniem stereochemii atomu węgla migrującej reszty.
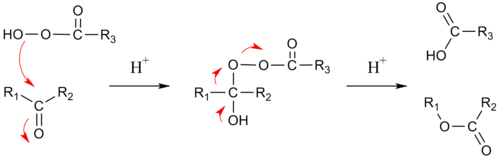
Kąt pomiędzy wiązaniami R-C-O-O w strukturze przejściowej podczas etapu migracji reszty alkilowej musi wynosić 180°, aby oddziaływanie pomiędzy wiążącym wiązaniem sigma R-C a antywiążącym wiązaniem sigma O-O było najsilniejsze. Wyniki badań in silico wskazują, że etap ten jest wspomagany przez dwie lub trzy cząsteczki nadkwasu, umożliwiające przeniesienie protonu [6].

U ketonów niesymetrycznych migruje zwykle grupa lepiej stabilizująca ładunek dodatni. Cykliczne ketony tworzą w reakcji Baeyera-Villigera laktony, natomiast aldehydy tworzą kwasy karboksylowe. Jeśli jednak migrująca grupa jest trzeciorzędowa, zawiera bogatoelektronowe wiązanie wielokrotne lub stanowi pierścień aromatyczny, powstaje wówczas odpowiedni alkohol i kwas karboksylowy (reakcja Dakina). Czasami powstały niestabilny kwas karboksylowy przekształca się w alkohol.
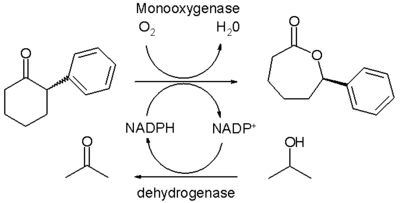
Biokatalityczne utlenianie Baeyera-Villigera
Reakcję Baeyera-Villigera można także przeprowadzić jako proces biokatalityczny za pomocą monooksygenazy Baeyera-Villigera (BVMO). Technika ta zapowiada się bardzo obiecująco ze względu na enancjoselektywność oraz zgodność z zasadami zielonej chemii. Sprawia jednak nie rozwiązane dotychczas problemy: wymaga konkretnego substratu, wysokie są koszty kofaktorów jak NADPH oraz samego enzymu (wymaga długotrwałego oczyszczania), występują zawady przestrzenne uniemożliwiające dostęp cząsteczek wody, stosowanej jako środowisko reakcji. Utlenianie in vivo za pomocą mikroorganizmów przysparza dodatkowych komplikacji.
Problem oczyszczania enzymu został poruszony w jednej publikacji [7], według której możliwe jest wyodrębnienie stabilnej termicznie monooksygenazy z określonego szczepu bakterii Escherichia coli. Enzym ten przekształca mieszaninę racemiczną 2-fenylocykloheksanonu w prawoskrętny lakton z 50% wydajnością oraz 94% nadmiarem enancjomerycznym. Reakcja zachodzi w dwufazowym układzie wody i heksanu. W każdym cyklu katalitycznym regenerowana jest NADPH za pomocą drugiego enzymu - dehydrogenazy, kosztem izopropanolu - stosowanego jako nieodnawialny katalizator. Z racji, że rozpuszczalność substratów i produktów w fazie wodnej jest niewielka, nie zachodzi inhibicja. Liczba obrotów w dla tej reakcji jest dużo większa niż w przypadku klasycznej katalizy asymetrycznej.
Zobacz też
- ↑ A. Baeyer, V. Villiger. Einwirkung des Caro'schen Reagens auf Ketone. „Chemische Berichte”, s. 3625–3633, 1899. DOI: 10.1002/cber.189903203151. ISSN 0365-9496. (niem.).
- ↑ A. Baeyer, V. Villiger. Ueber die Einwirkung des Caro'schen Reagens auf Ketone. „Chemische Berichte”, s. 858–864, 1900. DOI: 10.1002/cber.19000330115. ISSN 0365-9496. (niem.).
- ↑ C. M. Crudden, A. C. Chen, L. A. Calhoun. A Demonstration of the Primary Stereoelectronic Effect in the Baeyer-Villiger Oxidation of ?-Fluorocyclohexanones. „Angew. Chem. Int. Ed.”, s. 2851–2855, 2000. DOI: 10.1002/1521-3773(20000818)39:16%3C2851::AID-ANIE2851%3E3.0.CO;2-Y. (ang.).
- ↑ Burton, J.W.; Clark, J.S.; Derrer, S.; Stork, T.C.; Bendall, J.G.; Holmes, A.B.. Synthesis of Medium Ring Ethers. 5. The Synthesis of (+)-Laurencin. „J. Am. Chem. Soc.”, s. 7483–7498, 1997. DOI: 10.1021/ja9709132. (ang.).
- ↑ Michael Renz, Bernard Meunier. 100 Years of Baeyer-Villiger Oxidations. „European Journal of Organic Chemistry”, s. 737–750, 1999. DOI: 10.1002/(SICI)1099-0690(199904)1999:4%3C737::AID-EJOC737%3E3.0.CO;2-B. (ang.).
- ↑ a b The Role of Hydrogen Bonds in Baeyer-Villiger Reactions Shinichi Yamabe and Shoko Yamazaki J. Org. Chem.; 2007; 72(8) pp 3031 - 3041; Szablon:Doi
- ↑ Frank Schulz; François Leca; Frank Hollmann; Manfred T Reetz. Towards practical biocatalytic Baeyer-Villiger reactions: applying a thermostable enzyme in the gram-scale synthesis of optically active lactones in a two-liquid-phase system. „Beilstein Journal of Organic Chemistry”, s. 10, 2005. DOI: 10.1186/1860-5397-1-10. PMID: 16542025. (ang.).
