Mięśniakomięsak gładkokomórkowy
| leiomyosarcoma | |
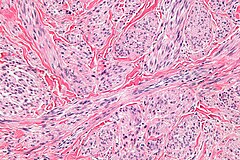 Mięśniakomięsak gładkokomórkowy skóry | |
| Klasyfikacje | |
| ICD-10 |
C49 |
|---|---|
| ICDO |
8890/3 |
Mięśniakomięsak gładkokomórkowy (łac. leiomyosarcoma) – rzadki nowotwór złośliwy wywodzący się z tkanki mięśniowej gładkiej należący do grupy mięsaków tkanek miękkich. Jest to jeden z najczęściej występujących mięsaków tkanek miękkich u ludzi. Klinicznie pod względem lokalizacji jest dzielony na mięsaka przestrzeni zaotrzewnowej i jamy brzusznej, mięsaka kończyn i tułowia, mięsaka naczyń krwionośnych i mięsaka skóry. Głównym objawem jest stwierdzenie obecności guza w tkankach miękkich, ale nowotwór może być przyczyną objawów wynikających z ucisku lub nacieku sąsiednich struktur anatomicznych. Podejrzenie obecności mięsaka tkanek miękkich jest stawiane na podstawie badań obrazowych, ale ostateczne rozpoznanie mięśniakomięsaka gładkokomórkowego jest możliwe wyłącznie na podstawie badania histopatologicznego materiału pobranego drogą biopsji. Podstawą leczenia choroby bez przerzutów jest resekcja z zachowaniem odpowiedniego marginesu zdrowych tkanek. U części chorych konieczne jest adiuwantowa radioterapia. Leczenie choroby z przerzutami polega na chemioterapii opartej na doksorubicynie, aktywność wykazują również dakarbazyna, trabektedyna i pazopanib stosowane zwykle w dalszych liniach leczenia.
Epidemiologia
[edytuj | edytuj kod]Mięśniakomięsak gładkokomórkowy jest jednym z najczęstszych mięsaków tkanek miękkich u ludzi[1][2], stanowi około 5–10% przypadków mięsaków tkanek miękkich u ludzi[3]. Jest jednym z najważniejszych mięsaków przestrzeni zaotrzewnowej, najczęstszym mięsakiem dużych naczyń krwionośnych, a także stanowi 10–15% wszystkich mięsaków tkanek miękkich kończyn[4]. Jest to najczęstszy mięsak macicy u ludzi, stanowi około 1,3% przypadków nowotworów złośliwych tego narządu[5][6].
U ludzi mięśniakomięsak gładkokomórkowy występuje głównie u osób w wieku średnim i starszym, choć może występować u osób młodych, a rzadko również u dzieci[4]. Szczyt zachorowań przypada na szóstą dekadę[7][8]. Generalnie częściej występuje u kobiet niż u mężczyzn[3]. W przybliżeniu około dwóch trzecich mięśniakomięsak gładkokomórkowych w przestrzeni pozaotrzewnowej i trzy czwarte w żyle głównej dolnej stwierdza się u kobiet[3][9].
Objawy kliniczne
[edytuj | edytuj kod]Głównym objawem mięśniakomięsaka gładkokomórkowego jest stwierdzenie obecności nieprawidłowej masy w tkankach miękkich[4][10]. Podobnie jak inne mięsaki mięśniakomięsak gładkokomórkowy może wywoływać niespecyficzne objawy związane z uciskiem, przemieszczeniem lub naciekiem sąsiednich struktur[10]. W obrębie przestrzeni zaotrzewnowej guz może wywoływać ból, nudności, wymioty, utratę masy ciała[3][4]. Wzrost nowotworu w obrębie żyły głównej dolnej powoduje jej zwężenie do niedrożności wywołując zespół żyły głównej dolnej, a zamknięcie żył wątrobowych zespół Budda-Chiariego[4][11].
Histopatologia
[edytuj | edytuj kod]

Mięśniakomięsak gładkokomórkowy występuje przede wszystkim w obrębie kończyny dolnej, choć faktycznie może występować w każdej lokalizacji. Kolejnym typem klinicznym jest lokalizacja w obrębie dużych naczyń krwionośnych, głównie żyły głównej dolnej. Występowanie w naczyniach tętniczych jest rzadkie. Czwartą grupą jest lokalizacja w obrębie skóry właściwej[4]. Makroskopowo guz tworzy mięsistą, cielistą masę koloru szarego do białego lub jasnobrązowego. W pewnym stopniu zmiany mogą mieć pozawijany wygląd przypominający mięśniaka gładkokomórkowego[12][13]. Guz zwykle jest dobrze odgraniczony, choć może naciekać sąsiednie narządy, szczególnie w przypadku mięsaka w przestrzeni zaotrzewnowej. W większych guzach może być obecna martwica, ogniska krwotoczne i zmiany torbielowate[12]. Mikroskopowo mięśniakomięsak gładkokomórkowy jest utworzony przez ostro odgraniczone grupy komórek o wrzecionowatym kształcie[12]. Komórki zwykle są ułożone w pęczki, w dobrze zróżnicowanych guzach podłużne i poprzeczne pęczki mogą krzyżować się niemal pod kątem prostym. Jednak w licznych miejscach wzór nie jest tak dobrze uporządkowany i przeplatany wzór nowotworu może przypominać włókniakomięsak typu dorosłych[13]. Komórki są wydłużonego, wrzecionowatego kształtu, zawierają obfitą ilość cytoplazmy, jądro komórkowe jest charakterystycznie wydłużone. Jądra komórkowe mogą wykazać hiperchromazję i pleomorfizm. Zwykle są obecne figury mitotyczne. Cytoplazma może być eozynofilna do bladej[12].
Guzy przestrzeni zaotrzewnowej częściej dają przerzuty odległe od guzów w obwodowej tkance łącznej. Przerzuty najczęściej występują w płucach (53% chorych z chorobą przerzutową) i w wątrobie (47%), rzadziej w obrębie tkanki łącznej, węzłów chłonnych, kości i przewodu pokarmowego[14].
Lokalizacja
[edytuj | edytuj kod]- Mięśniakomięsak gładkokomórkowy przestrzeni zaotrzewnowej i jamy brzusznej
Około 50–75% mięśniakomięsaków gładkokomórkowych jest zlokalizowana w przestrzeni pozaotrzewnowej[3], jest to drugi po tłuszczakomięsaku pod względem częstości mięsak przestrzeni zaotrzewnowej u ludzi[14]. W tej lokalizacji guz występuje znacznie częściej u kobiet[3]. Zwykle guzy są rozpoznawane gdy osiągają wielkość około 5 cm, ale możliwa jest obecność masy o średnicy przekraczającej 10 cm. Nowotwór często nacieka sąsiednie struktury, w tym nerki, trzustkę i kręgosłup[13].
- Mięśniakomięsak gładkokomórkowy kończyn i tułowia (somatycznej tkanki łącznej)
Jest to rzadsza lokalizacja w porównaniu do przestrzeni zaotrzewnowej. Guzy najczęściej występują w kończynie dolnej. Około połowę z tych guzów stwierdza się w tkance podskórnej, resztę w obrębie mięśni. W tej lokalizacji mięsak występuje po równo u obu płci[15].
- Mięśniakomięsak gładkokomórkowy naczyń krwionośnych
Jest to bardzo rzadka lokalizacja mięśniakomięsaka gładkokomórkowego. Guz jest obecny w dużych naczyniach krwionośnych. Najczęściej jest stwierdzany w żyle głównej dolnej, 80–90% chorych to kobiety. Rzadziej guz wzrasta w żyłach biodrowych, udowej lub odpiszczelowej[11]. W naczyniach tętniczych nowotwór najczęściej pojawia się w pniu płucnym[16]. Nowotwór może również pojawiać się w obrębie małych naczyń i prawdopodobnie większość przypadków mięśniakomięsaka gładkokomórkowego wywodzącego się z małych naczyń pozostaje nierozpoznana[11].
- Mięśniakomięsak gładkokomórkowy skóry
Jest to typ mięśniakomięsaka gładkokomórkowego, który pierwotnie obejmuje skórę właściwą i wtórnie może zajmować tkankę podskórną[15]. Nowotwór wywodzi się z mięśnia przywłosowego lub błony kurczliwej moszny, główną lokalizacją są kończyny po stronie prostowników, w mniejszym stopniu skalp i tułów. Częściej występuje u mężczyzn, zwykle pojawia się w szóstej dekadzie życia, wyjątkowo rzadko również u dzieci[17]. Klinicznie występuje jako lita zmiana w obrębie skóry o wielkości mniejszej niż 2 cm, często powoduje owrzodzenie lub odbarwienie leżącej nad zmianą skóry[18].
Etiologia
[edytuj | edytuj kod]Etiologia choroby nie została dobrze poznana[12]. Oceniono wiele zewnętrznych czynników etiologicznych. Zaobserwowano, że infekcja wirusem Epsteina-Barr u chorych z nabytą immunosupresją w przebiegu AIDS lub farmakologiczną związaną z przeszczepieniem narządu jest związana z występowaniem nowotworów tkanki mięśniowej gładkiej, w tym mięśniakomięsaka gładkokomórkowego, których większość mięśniakomięsaków gładkokomórkowych pojawia się u dzieci i młodych dorosłych[3][7]. Ze względu na większą częstość występowania u kobiet oraz współwystępowanie nowotworu z ciążą postulowany jest związek mięsaka ze stymulacją estrogenową, choć rola estrogenu w etiologii choroby pozostaje niejasna[7][3][19][20]. Chorzy z wrodzoną mutacją genu RB1 predysponującą do rozwoju siatkówczaka mają zwiększone ryzyko rozwoju mięśniakomięsaka gładkokomórkowego[3][7][21][22]. Zwiększone ryzyko choroby występuje również u chorych z zespołem Li-Fraumeni[7][23]. Dziedziczna mięśniakowatość gładkokomórkowa i rak nerkowokomórkowy również jest związana ze zwiększonym ryzykiem zachorowania na mięśniakomięsaka gładkokomórkowego macicy[10][24]. Czynnikiem ryzyka zachorowania może być radioterapia[10].
Rozpoznanie
[edytuj | edytuj kod]

Podejrzenie mięsaka, w tym mięśniakomięsaka gładkokomórkowego, jest stawiane na podstawie badania klinicznego oraz badań obrazowych. Badania obrazowe nie pozwalają na rozpoznanie konkretnego typu mięsaka, jednak umożliwiają na wstępne rozpoznanie choroby nowotworowej, zaplanowanie biopsji, a także na ocenę zaawansowania choroby[25]. Podstawą rozpoznania mięsaka tkanek miękkich, w tym mięśniakomięsaka gładkokomórkowego, jest wynik badania histopatologicznego materiału uzyskanego drogą biopsji diagnostycznej lub materiału (preparatu) pooperacyjnego[26].
Badania obrazowe
[edytuj | edytuj kod]Badania obrazowe wykonywane są w początkowym etapie diagnostyki mięsaków tkanek miękkich. Pozwalają na postawienie klinicznego podejrzenia choroby nowotworowej i zaplanowanie biopsji, która z kolei umożliwia wykonanie badania histopatologicznego dającego ostateczne rozpoznanie choroby i określającego typ histologiczny choroby[27].
Rezonans magnetyczny (MRI) jest preferowanym badaniem w ocenie guzów w lokalizacji kończynowej, w obrębie powłok tułowia oraz miednicy[28]. Badanie umożliwia dokładną ocenę struktur naczynio-nerwowych i przedziałów mięśniowych[29]. Tomografię komputerową (TK) stosuje się w diagnostyce zmian z przestrzeni pozaotrzewnowej i śródotrzewnowej, gdzie wykazuje podobną skuteczność jak rezonans magnetyczny[29][28], choć rezonans magnetyczny może być przydatny do oceny zajęcia struktur naczyniowych[1]. Tomografia komputerowa jest lepszym badaniem w ocenie nacieku kości lub oceny zwapniałych zmian[29][28]. Zdjęcie rentgenowskie jest przydatne do różnicowania głęboko położonych mięsaków tkanek miękkich od mięsaków kości naciekających tkanki miękkie[29]. W celu wykluczenia obecności przerzutów odległych w płucach może być stosowana tomografia komputerowa klatki piersiowej lub zdjęcie rentgenowskie[29]. Ultrasonografia (USG) ma zastosowanie wyłącznie w ramach wstępnej diagnostyki i wymaga przeprowadzenia dokładniejszych badań, takich jak TK lub MRI[28].
Biopsja
[edytuj | edytuj kod]
Standardowym postępowaniem po wykonaniu badań obrazowych jest diagnostyczna biopsja gruboigłowa lub biopsja wycinająca w przypadku powierzchniowych (znajdujących się powyżej powięzi) zmian o wielkości poniżej 3 cm[28]. Biopsja jest planowana w taki sposób, aby nie utrudniać wykonania radykalnego onkologicznie leczenia miejscowego, a miejsce jej przebiegu w tkankach i powstająca po niej blizna w miarę możliwości mogły zostać wycięte podczas resekcji nowotworu[28][26]. Miejsce wykonania biopsji może być oznaczane tatuażem[28].
Badanie histopatologiczne
[edytuj | edytuj kod]Badanie histopatologiczne materiału uzyskanego w biopsji lub preparatu pooperacyjnego umożliwia ostateczne rozpoznanie mięśniakomięsaka gładkokomórkowego, pozwala ocenić zaawansowanie choroby oraz dostarcza istotnych rokowniczo informacji. Rozpoznanie opiera się na ocenie atypii, martwicy i aktywności mitotycznej[30].
Nie ma specyficznego profilu immunohistochemicznego charakterystycznego dla mięśniakomięsaka gładkokomórkowego[30]. W większości przypadków tego nowotworu stwierdza się pozytywną reakcję w kierunku SMA, desminy i h-caldesmonu. Reakcja może być również dodatnia w przypadku keratyny, EMA, CD34 i S100. Reakcja w kierunku KIT (CD117), w odróżnieniu od guzów stromalnych (GIST), jest negatywna[31]. Nie rozpoznano typowych zmian w badaniach cytogenetycznych, często stwierdza się utratę regionów 3p21-23, 8p21, 13q12-13, 13q32 i uzyskanie dodatkowej kopii regionu 1q21-31[32].
Leczenie
[edytuj | edytuj kod]Leczenie choroby bez przerzutów
[edytuj | edytuj kod]Resekcja guza z zachowaniem odpowiedniego marginesu zdrowych tkanek bez nacieku nowotworowego (resekcja R0) jest podstawową metodą leczenia mięsaków tkanek miękkich, także mięśniakomięsaka gładkokomórkowego[10]. Jest to jedyna metoda leczenia pozwalającą na całkowite wyleczenie choroby[30]. Dąży się do resekcji nowotworu w jednym bloku tkankowym (en block), aby zwiększyć szansę na osiągnięcie wolnego mikroskopowo od nacieku mięsaka marginesu zdrowych tkanek[10][33]. W przypadku bliskości lub przemieszczenia ważnych struktur naczyniowo-nerwowych ich resekcja nie jest konieczna, gdy jest możliwa dysekcja przydanki naczynia lub onerwia bez bezpośredniego nacieku tych struktur[34]. Zachowanie odpowiedniego marginesu tkanek wolnego od nowotworu jest trudne w przypadku dużych guzów oraz nacieku ważnych dla życia struktur anatomicznych[30]. Z kolei w umiejscowieniu mięsaka w obrębie kończyny dąży się do wykonania zabiegu funkcjonalnie oszczędzającego kończynę, jeśli pozwala to na radykalną onkologicznie resekcję mięsaka[34]. Amputacja jest konieczna w przypadku resekcji guza powodującej zniesienia funkcji kończyny[35]. Lokalizacja choroby w obrębie żyły głównej dolnej wymaga jej resekcji i najczęściej zachodzi konieczność jej odtworzenia[36]. Miejsca o zwiększonym ryzyku resekcji z mikroskopowym lub makroskopowym naciekiem nowotworu, w celu ułatwienia wykonania pooperacyjnej radioterapii, oznacza się klipsem[33]. W przypadku nieuzyskania ujemnych mikroskopowo marginesów (resekcja R1) może być konieczna reoperacja w ośrodku referencyjnym, a w przypadku resekcji bez zachowanych makroskopowo ujemnych marginesów (resekcja R2) reoperacja jest obligatoryjna[37].
Leczenie adiuwantowe
[edytuj | edytuj kod]Adiuwantowa radioterapia jest standardowym leczeniem uzupełniającym mięsaków tkanek miękkich, w tym mieśniakomięsaków gładkokomórkowych[10][38], po resekcji głębokich guzów o wielkości powyżej 5 cm i wysokiej złośliwości histologicznej (G2-G3)[37]. Radioterapia poprawia lokalną kontrolę choroby i zmniejsza ryzyko wznowy, jednak nie zwiększa przeżycia całkowitego chorych[39][10].
Adiuwantowa chemioterapia nie jest standardowym leczeniem uzupełniającym mięsaków tkanek miękkich[10]. W metaanalizie kilku badań oceniających u chorych z mięsakiem tkanek miękkich leczenie adiuwantowe za pomocą doksorubicyny i ifosfamidu stwierdzono, że terapia opóźnia nawrót choroby, ale nie przedłuża przeżycia całkowitego chorych (OS)[40]. Również w badaniu klinicznym na 351 chorych połączenie doksorubicyny i ifosfamidu nie poprawiało przeżycia całkowitego[41]. U innym badaniu chore z mięśniakomięsakiem gładkokomórkowym macicy leczone połączeniem gemcytabiny z docetakselem, a następnie doksorubicyną osiągnęły medianę przeżycia 9,8 miesiąca, 78% odsetek dwuletniego przeżycia wolnego od progresji choroby (PFS) i 57% odsetek trzyletniego przeżycia wolnego od progresji choroby[42].
Leczenie choroby zaawansowanej miejscowo i choroby z przerzutami
[edytuj | edytuj kod]Podstawą leczenia zaawansowanego lub przerzutowego mięśniakomięsaka gładkokomórkowego jest chemioterapia oparta na doksorubicynie[30]. W leczeniu tego mięsaka aktywność wykazuje również dakarbazyna, trabektedyna i pazopanib. Ifosfamid, który jest obok doksorubicyny podstawowym lekiem w leczeniu mięsaków tkanek miękkich, prawdopodobnie wykazuje mniejszą aktywność w leczeniu mięśniakomięsaka gładkokomórkowego[43].
W dwóch dużych badaniach oceniających skuteczność chemioterapii mięsaków tkanek miękkich opartej na antracyklinach (doksorubicynie, epirubicynie)[44] oraz ifosmamidzie[45] nie stwierdzono, aby typ histopatologiczny mięsaka był czynnikiem prognostycznym odpowiedzi na leczenie i nie stwierdzono znaczących różnic w odpowiedzi w którymkolwiek ocenianym typie histopatologicznym mięsaków tkanek miękkich[10]. Jednak w badaniu retrospektywnym oceniającym odpowiedź na leczenie za pomocą schematów opartych na ifosfamidzie stwierdzono niższy odsetek odpowiedzi na leczenie i przeżycia wolnego od progresji[45][10][46][43].
Aktywność w leczeniu mięśniakomięsaka gładkokomórkowego wykazuje gemcytabina, szczególnie w leczeniu mięśniakomięsaka gładkokomórkowego macicy[47][48][49][50][10]. W badaniu II fazy stwierdzono, że połączenie gemcytabiny z docetakselem wykazuje przewagę nad monoterapią gemcytabiną. Połączenie wywołuje wyższy odsetek odpowiedzi, wydłuża medianę przeżycia wolnego od progresji choroby i medianę przeżycia całkowitego wynoszącą odpowiednio 17,9 miesiąca dla połączenia i 11,5 miesiąca dla monoterapii[51]. Z kolei w innym badaniu stwierdzono, że połączenie daje korzyści terapeutyczne wyłącznie w leczeniu mięśniakomięsaka gładkokomórkowego macicy[52].
W leczeniu mięśniakomięsaka gładkokomórkowego może być wykorzystana dakarbazyna (DTIC)[46]. Stwierdzono przewagę połączenia dakarbazyny z doksorubicyną nad monoterapią doksorubicyny[53][46]. Podobnie w badaniu II fazy stwierdzono przewagę połączenia dakarbazyny z gemcytabiną nad monoterapią dakarbazyny[54].
Trabektedyna jest zalecanym leczeniem II-linii po nieskuteczności leczenia za pomocą doksorubicyny[55]. Lek wykazuje wyższą aktywność w leczeniu mięśniakomięsaka gładkokomórkowego i tłuszczakomięsaka śluzowatego w porównaniu do innych mięsaków tkanek miękkich[56][30]. Zaobserwowano, że trabektedyna wywołuje wysoki odsetek kontroli choroby[10][57][58].
Pazopanib jest lekiem celowanym blokującym kinazę tyrozynową receptorów naczyniowego czynnika wzrostu nabłonka (VEGFR), płytkowopochodnego czynnika wzrostu (PDGFR) oraz receptora czynnika komórek macierzystych (c-KIT)[10]. W badaniu II fazy stwierdzono aktywność pazopanibu w leczeniu mięśniakomięsaka gładkokomókowego[59]. W badaniu III fazy u chorych z progresją po wcześniejszej chemioterapii pazopanib porównano z placebo, zaobserwowano wydłużenie czasu wolnego od progresji choroby (PFS), ale nie stwierdzono istotnego statystycznie wydłużenia czasu przeżycia całkowitego (OS)[60][10][30].
Zaawansowanie kliniczne
[edytuj | edytuj kod]Zaawansowanie mięśniakomięsaka gładkokomórkowego jest oceniane w klasyfikacji TNM dla mięsaków tkanek miękkich.
| Guz pierwotny – cecha T | |
| Tx | nie można ocenić guza pierwotnego |
| T0 | nie stwierdza się guza pierwotnego |
| T1 | guz mniejszy lub równy 5 cm |
| T1a | powierzchniowy guz |
| T1b | głęboki guz |
| T2 | guz powyżej 5 cm |
| T2a | powierzchniowy guz |
| T2b | głęboki guz |
| Zajęcie okolicznych węzłów chłonnych – cecha N | |
| Nx | nie można ocenić okolicznych węzłów chłonnych |
| N0 | nie stwierdza się przerzutów w okolicznych węzłach chłonnych |
| N1 | przerzuty obecne w węzłach chłonnych |
| Przerzuty odległe – cecha M | |
| M0 | nie stwierdza się przerzutów odległych |
| M1 | obecne przerzuty odległe |
| Stopień złośliwości histologicznej | ||||
| Stopień | G1 | G2 | G3 | |
| Punkty | 2–3 | 4–5 | 6–8 | |
| Kryteria | ||||
| Punkty | 0 | 1 | 2 | 3 |
| Zróżnicowanie guza | – | wysokie | pośrednie | niskie |
| Martwica | brak | <50% | >50% | – |
| Indeks mitotyczny | – | <10 | 10–19 | >20 |
| Stopień zaawansowania | Cecha T | Cecha N | Cecha M | Cecha G |
| IA | T1a | N0 | M0 | Gx |
| T1b | N0 | M0 | Gx | |
| T1a | N0 | M0 | G1 | |
| T1b | N0 | M0 | G1 | |
| IB | T2a | N0 | M0 | Gx |
| T2a | N0 | M0 | Gx | |
| T2a | N0 | M0 | G1 | |
| T2b | N0 | M0 | G1 | |
| IIA | T1a | N0 | M0 | G2 |
| T1b | N0 | M0 | G3 | |
| T1b | N0 | M0 | G2 | |
| T1b | N0 | M0 | G3 | |
| IIB | T2a | N0 | M0 | G2 |
| T2b | N0 | M0 | G2 | |
| III | T2a | N0 | M0 | G3 |
| T2b | N0 | M0 | G3 | |
| każde T | N1 | M0 | każde G | |
| IV | każde T | każde N | M1 | każde G |
Rokowanie
[edytuj | edytuj kod]Rokowanie zależy od lokalizacji nowotworu, stopnia złośliwości histologicznej, wielkości guza i stopnia zaawansowania choroby. Obecność przerzutów znacznie pogarsza rokowanie, które jest złe[10]. W większości badań klinicznych chorzy z chorobą z przerzutami osiągają medianę przeżycia wolnego od progresji choroby wynoszącą około 12–15 miesięcy[62][10].
Różne anatomiczne warianty, mimo podobnej histopatologii, niosą ze sobą różne ryzyko wznowy i powstania przerzutów odległych, a tym samym wiążą się z odmiennym rokowaniem. Gorsze rokowanie niesie ze sobą guz przestrzeni zaotrzewnowej i jamy brzusznej oraz postać naczyniowa choroby, z kolei lepsze mieśniakomięsak gładkokomórkowy kończyn i tułowia (somatycznej tkanki łącznej) i skóry[30].
Mięśniakomięsaki gładkokomórkowe przestrzeni zaotrzewnowej i jamy brzusznej są guzami o wysokiej agresywności, zwykle w momencie rozpoznania nowotwór osiąga znaczne rozmiary, które utrudniają jego całkowitą resekcję, która jest rzadko osiągana[30]. Mediana całkowitego przeżycia dla tej lokalizacji nowotworu wynosi 52 miesięcy, a odsetek pięcioletniego przeżycia wynosi 46%[63][15].
Mięśniakomięsak gładkokomórkowy tułowia i kończyn (somatycznej tkanki łącznej) cechuje się lepszym rokowaniem niż guz w przestrzeni zaotrzewnowej. U chorych bez przerzutów odległych u 75% udaje się przeprowadzić radykalną resekcję, po 10 latach u 84% z nich nie obserwuje się lokalnego nawrotu, a u 66% z nich nie obserwuje się rozwoju przerzutów odległych[64][15]. Szacuje się, że odsetek przeżycia całkowitego wynosi 57%, a dziesięcioletniego 19%[65].
Rokowanie w mięśniakomięsaku gładkokomórkowym skóry zwykle jest bardzo dobre. Mięsak obejmujący wyłącznie skórę szerzy się tylko lokalnie i nie daje przerzutów odległych, przy zajęciu tkanki podskórnej przerzuty są obserwowane w 30–40% przypadków[18]. Postać naczyniowa rokuje źle, ze względu na lokalne szerzenie się guza i obecność przerzutów odległych[30].
Klasyfikacja ICD10
[edytuj | edytuj kod]| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: C49 | Nowotwór złośliwy tkanki łącznej i innych tkanek miękkich |
| ICD-10: C49.0 | Tkanka łączna i inne tkanki miękkie głowy, twarzy i szyi |
| ICD-10: C49.1 | Tkanka łączna i inne tkanki miękkie kończyny górnej, łącznie z barkiem |
| ICD-10: C49.2 | Tkanka łączna i inne tkanki miękkie kończyny dolnej, łącznie z biodrem |
| ICD-10: C49.3 | Tkanka łączna i inne tkanki miękkie klatki piersiowej |
| ICD-10: C49.4 | Tkanka łączna i inne tkanki miękkie brzucha |
| ICD-10: C49.5 | Tkanka łączna i inne tkanki miękkie miednicy |
| ICD-10: C49.6 | Tkanka łączna i inne tkanki miękkie tułowia, umiejscowienie nieokreślone |
| ICD-10: C49.8 | Zmiana przekraczająca granice jednego umiejscowienia w obrębie tkanki łącznej i tkanek
miękkich |
| ICD-10: C49.9 | Tkanka łączna i inne tkanki miękkie, umiejscowienie nieokreślone |
Przypisy
[edytuj | edytuj kod]- ↑ a b Brennan, Antonescu i Maki 2012 ↓, s. 113.
- ↑ von Mehren i in. 2016 ↓, s. 52.
- ↑ a b c d e f g h i Goldblum, Weiss i Folpe 2013 ↓, s. 549.
- ↑ a b c d e f Fletcher, Unni i Mertens 2002 ↓, s. 131.
- ↑ Jonathan A. Ledermann, Carien L. Creutzberg, Michael A. Quinn: Controversies in the Management of Gynecological Cancers. Springer Science & Business Media, 2013, s. 309. ISBN 978-0-85729-910-9.
- ↑ Noel Weidner, Richard J. Cote, Saul Suster, Lawrence M. Weiss: Modern Surgical Pathology. Elsevier Health Sciences, 2009, s. 1327. ISBN 978-1-4377-1958-1.
- ↑ a b c d e Wagner 2013 ↓, s. 958.
- ↑ P. Gustafson, H. Willén, B. Baldetorp, M. Fernö i inni. Soft tissue leiomyosarcoma. A population-based epidemiologic and prognostic study of 48 patients, including cellular DNA content. „Cancer”. 70 (1), s. 114–119, Jul 1992. PMID: 1606532.
- ↑ Wagner 2013 ↓, s. 957–958.
- ↑ a b c d e f g h i j k l m n o p q F. Duffaud, I. Ray-Coquard, S. Salas, P. Pautier. Recent advances in understanding and managing leiomyosarcomas. „F1000Prime Rep”. 7, s. 55, 2015. DOI: 10.12703/P7-55. PMID: 26097728.
- ↑ a b c Goldblum, Weiss i Folpe 2013 ↓, s. 561.
- ↑ a b c d e Fletcher, Unni i Mertens 2002 ↓, s. 132.
- ↑ a b c Goldblum, Weiss i Folpe 2013 ↓, s. 550.
- ↑ a b Mark J. Kransdorf, Mark D. Murphey: Imaging of Soft Tissue Tumors. Lippincott Williams & Wilkins, 2006, s. 307. ISBN 978-0-7817-4771-4.
- ↑ a b c d Goldblum, Weiss i Folpe 2013 ↓, s. 559.
- ↑ Goldblum, Weiss i Folpe 2013 ↓, s. 561–562.
- ↑ LeBoit i in. 2006 ↓, s. 251.
- ↑ a b Goldblum, Weiss i Folpe 2013 ↓, s. 560.
- ↑ M. Miettinen. Smooth muscle tumors of soft tissue and non-uterine viscera: biology and prognosis. „Mod Pathol”. 27 Suppl 1, s. S17-29, Jan 2014. DOI: 10.1038/modpathol.2013.178. PMID: 24384850.
- ↑ B. Purgina, U.N. Rao, M. Miettinen, L. Pantanowitz. AIDS-Related EBV-Associated Smooth Muscle Tumors: A Review of 64 Published Cases. „Patholog Res Int”. 2011, s. 561548, 2011. DOI: 10.4061/2011/561548. PMID: 21437186.
- ↑ J.H. Francis, R.A. Kleinerman, J.M. Seddon, D.H. Abramson. Increased risk of secondary uterine leiomyosarcoma in hereditary retinoblastoma. „Gynecol Oncol”. 124 (2), s. 254–259, Feb 2012. DOI: 10.1016/j.ygyno.2011.10.019. PMID: 22027510.
- ↑ von Mehren i in. 2016 ↓, s. 53.
- ↑ S. Ognjanovic, M. Olivier, T.L. Bergemann, P. Hainaut. Sarcomas in TP53 germline mutation carriers: a review of the IARC TP53 database. „Cancer”. 118 (5), s. 1387–1396, Mar 2012. DOI: 10.1002/cncr.26390. PMID: 21837677.
- ↑ A.D. Pinheiro, D.C. Wright. Naloxone eliminates passive avoidance retention deficits produced by pretest exposure to novelty in rats. „Behav Neural Biol”. 55 (3), s. 270–288, May 1991. PMID: 1647763.
- ↑ Krzakowski i in. 2015 ↓, s. 878.
- ↑ a b Krzakowski i in. 2015 ↓, s. 880.
- ↑ Krzakowski i in. 2015 ↓, s. 878–880.
- ↑ a b c d e f g Casali i in. 2014 ↓, s. 1.
- ↑ a b c d e Krzakowski i in. 2015 ↓, s. 879.
- ↑ a b c d e f g h i j A.J. Bathan, A. Constantinidou, S.M. Pollack, R.L. Jones. Diagnosis, prognosis, and management of leiomyosarcoma: recognition of anatomic variants. „Curr Opin Oncol”. 25 (4), s. 384–389, Jul 2013. DOI: 10.1097/CCO.0b013e3283622c77. PMID: 23635801.
- ↑ Fletcher, Unni i Mertens 2002 ↓, s. 132–133.
- ↑ Fletcher, Unni i Mertens 2002 ↓, s. 133.
- ↑ a b von Mehren i in. 2016 ↓, s. 56.
- ↑ a b von Mehren i in. 2016 ↓, s. 37.
- ↑ von Mehren i in. 2016 ↓, s. 62.
- ↑ Brennan, Antonescu i Maki 2012 ↓, s. 119.
- ↑ a b c d Casali i in. 2014 ↓, s. 3.
- ↑ Brennan, Antonescu i Maki 2012 ↓, s. 120.
- ↑ J.C. Yang, A.E. Chang, A.R. Baker, W.F. Sindelar i inni. Randomized prospective study of the benefit of adjuvant radiation therapy in the treatment of soft tissue sarcomas of the extremity. „J Clin Oncol”. 16 (1), s. 197–203, Jan 1998. PMID: 9440743.
- ↑ N. Pervaiz, N. Colterjohn, F. Farrokhyar, R. Tozer i inni. A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. „Cancer”. 113 (3), s. 573–581, Aug 2008. DOI: 10.1002/cncr.23592. PMID: 18521899.
- ↑ P.J. Woll, P. Reichardt, A. Le Cesne, S. Bonvalot i inni. Adjuvant chemotherapy with doxorubicin, ifosfamide, and lenograstim for resected soft-tissue sarcoma (EORTC 62931): a multicentre randomised controlled trial. „Lancet Oncol”. 13 (10), s. 1045–1054, Oct 2012. DOI: 10.1016/S1470-2045(12)70346-7. PMID: 22954508.
- ↑ M.L. Hensley, J.K. Wathen, R.G. Maki, D.M. Araujo i inni. Adjuvant therapy for high-grade, uterus-limited leiomyosarcoma: results of a phase 2 trial (SARC 005). „Cancer”. 119 (8), s. 1555–1561, Apr 2013. DOI: 10.1002/cncr.27942. PMID: 23335221.
- ↑ a b Casali i in. 2014 ↓, s. 7.
- ↑ M. Van Glabbeke, A.T. van Oosterom, J.W. Oosterhuis, H. Mouridsen i inni. Prognostic factors for the outcome of chemotherapy in advanced soft tissue sarcoma: an analysis of 2,185 patients treated with anthracycline-containing first-line regimens--a European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group Study. „J Clin Oncol”. 17 (1), s. 150–157, Jan 1999. PMID: 10458228.
- ↑ a b S. Sleijfer, M. Ouali, M. van Glabbeke, A. Krarup-Hansen i inni. Prognostic and predictive factors for outcome to first-line ifosfamide-containing chemotherapy for adult patients with advanced soft tissue sarcomas: an exploratory, retrospective analysis on large series from the European Organization for Research and Treatment of Cancer-Soft Tissue and Bone Sarcoma Group (EORTC-STBSG). „Eur J Cancer”. 46 (1), s. 72–83, Jan 2010. DOI: 10.1016/j.ejca.2009.09.022. PMID: 19853437.
- ↑ a b c Brennan, Antonescu i Maki 2012 ↓, s. 121.
- ↑ M.L. Hensley, R. Maki, E. Venkatraman, G. Geller i inni. Gemcitabine and docetaxel in patients with unresectable leiomyosarcoma: results of a phase II trial. „J Clin Oncol”. 20 (12), s. 2824–2831, Jun 2002. PMID: 12065559.
- ↑ J.O. Bay, I. Ray-Coquard, J. Fayette, S. Leyvraz i inni. Docetaxel and gemcitabine combination in 133 advanced soft-tissue sarcomas: a retrospective analysis. „Int J Cancer”. 119 (3), s. 706–711, Aug 2006. DOI: 10.1002/ijc.21867. PMID: 16496406.
- ↑ K.M. Leu, L.J. Ostruszka, D. Shewach, M. Zalupski i inni. Laboratory and clinical evidence of synergistic cytotoxicity of sequential treatment with gemcitabine followed by docetaxel in the treatment of sarcoma. „J Clin Oncol”. 22 (9), s. 1706–1712, May 2004. DOI: 10.1200/JCO.2004.08.043. PMID: 15117993.
- ↑ M.L. Hensley, J.A. Blessing, K. Degeest, O. Abulafia i inni. Fixed-dose rate gemcitabine plus docetaxel as second-line therapy for metastatic uterine leiomyosarcoma: a Gynecologic Oncology Group phase II study. „Gynecol Oncol”. 109 (3), s. 323–328, Jun 2008. DOI: 10.1016/j.ygyno.2008.02.024. PMID: 18394689.
- ↑ R.G. Maki, J.K. Wathen, S.R. Patel, D.A. Priebat i inni. Randomized phase II study of gemcitabine and docetaxel compared with gemcitabine alone in patients with metastatic soft tissue sarcomas: results of sarcoma alliance for research through collaboration study 002 [corrected]. „J Clin Oncol”. 25 (19), s. 2755–2763, Jul 2007. DOI: 10.1200/JCO.2006.10.4117. PMID: 17602081.
- ↑ P. Pautier, A. Floquet, N. Penel, S. Piperno-Neumann i inni. Randomized multicenter and stratified phase II study of gemcitabine alone versus gemcitabine and docetaxel in patients with metastatic or relapsed leiomyosarcomas: a Federation Nationale des Centres de Lutte Contre le Cancer (FNCLCC) French Sarcoma Group Study (TAXOGEM study). „Oncologist”. 17 (9), s. 1213–1220, 2012. DOI: 10.1634/theoncologist.2011-0467. PMID: 22907974.
- ↑ E.C. Borden, D.A. Amato, C. Rosenbaum, H.T. Enterline i inni. Randomized comparison of three adriamycin regimens for metastatic soft tissue sarcomas. „J Clin Oncol”. 5 (6), s. 840–850, Jun 1987. PMID: 3585441.
- ↑ X. García-Del-Muro, A. López-Pousa, J. Maurel, J. Martín i inni. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanish Group for Research on Sarcomas study. „J Clin Oncol”. 29 (18), s. 2528–2533, Jun 2011. DOI: 10.1200/JCO.2010.33.6107. PMID: 21606430.
- ↑ Casali i in. 2014 ↓, s. 5.
- ↑ Brennan, Antonescu i Maki 2012 ↓, s. 122.
- ↑ A. Le Cesne, J.Y. Blay, I. Judson, A. Van Oosterom i inni. Phase II study of ET-743 in advanced soft tissue sarcomas: a European Organisation for the Research and Treatment of Cancer (EORTC) soft tissue and bone sarcoma group trial. „J Clin Oncol”. 23 (3), s. 576–584, Jan 2005. DOI: 10.1200/JCO.2005.01.180. PMID: 15659504.
- ↑ B.L. Samuels, S. Chawla, S. Patel, M. von Mehren i inni. Clinical outcomes and safety with trabectedin therapy in patients with advanced soft tissue sarcomas following failure of prior chemotherapy: results of a worldwide expanded access program study. „Ann Oncol”. 24 (6), s. 1703–1709, Jun 2013. DOI: 10.1093/annonc/mds659. PMID: 23385197.
- ↑ S. Sleijfer, I. Ray-Coquard, Z. Papai, A. Le Cesne i inni. Pazopanib, a multikinase angiogenesis inhibitor, in patients with relapsed or refractory advanced soft tissue sarcoma: a phase II study from the European organisation for research and treatment of cancer-soft tissue and bone sarcoma group (EORTC study 62043). „J Clin Oncol”. 27 (19), s. 3126–3132, Jul 2009. DOI: 10.1200/JCO.2008.21.3223. PMID: 19451427.
- ↑ W.T. van der Graaf, J.Y. Blay, S.P. Chawla, D.W. Kim i inni. Pazopanib for metastatic soft-tissue sarcoma (PALETTE): a randomised, double-blind, placebo-controlled phase 3 trial. „Lancet”. 379 (9829), s. 1879–1886, May 2012. DOI: 10.1016/S0140-6736(12)60651-5. PMID: 22595799.
- ↑ Casali i in. 2014 ↓, s. 2.
- ↑ N. Penel, A. Italiano, N. Isambert, E. Bompas i inni. Factors affecting the outcome of patients with metastatic leiomyosarcoma treated with doxorubicin-containing chemotherapy. „Ann Oncol”. 21 (6), s. 1361–1365, Jun 2010. DOI: 10.1093/annonc/mdp485. PMID: 19880438.
- ↑ E. Stoeckle, J.M. Coindre, S. Bonvalot, G. Kantor i inni. Prognostic factors in retroperitoneal sarcoma: a multivariate analysis of a series of 165 patients of the French Cancer Center Federation Sarcoma Group. „Cancer”. 92 (2), s. 359–368, Jul 2001. PMID: 11466691.
- ↑ C. Svarvar, T. Böhling, O. Berlin, P. Gustafson i inni. Clinical course of nonvisceral soft tissue leiomyosarcoma in 225 patients from the Scandinavian Sarcoma Group. „Cancer”. 109 (2), s. 282–291, Jan 2007. DOI: 10.1002/cncr.22395. PMID: 17154171.
- ↑ J.A. Abraham, M.J. Weaver, J.L. Hornick, D. Zurakowski i inni. Outcomes and prognostic factors for a consecutive case series of 115 patients with somatic leiomyosarcoma. „J Bone Joint Surg Am”. 94 (8), s. 736–744, Apr 2012. DOI: 10.2106/JBJS.K.00460. PMID: 22517390.
Bibliografia
[edytuj | edytuj kod]- John R. Goldblum, Sharon W. Weiss, Andrew L. Folpe: Enzinger and Weiss’s Soft Tissue Tumors. Wyd. 6. Elsevier Health Sciences, 2013. ISBN 978-0323088343.
- Christopher D.M. Fletcher, K. Krishnan Unni, Fredrik Mertens: Pathology and Genetics of Tumours of Soft Tissue and Bone. Lyon: IARC Press, 2002.
- Murray F. Brennan, Cristina R. Antonescu, Robert G. Maki: Management of Soft Tissue Sarcoma. Springer Science & Business Media, 2012.
- P.G. Casali, J.Y. Blay, A. Bertuzzi, S. Bielack i inni. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. „Ann Oncol”. 25 Suppl 3, s. iii102-12, Sep 2014. DOI: 10.1093/annonc/mdu254. PMID: 25210080.
- Margaret von Mehren, R. Lor Randall, Robert S. Benjamin, Sarah Boles i inni. Soft Tissue Sarcoma Version 1.2016. „J Natl Compr Canc Netw”, 2016.
- Philip E. LeBoit, Günter Burg, David Weedon, Alain Sarasin: Pathology and Genetics of Skin Tumours. IARC Press, 2006. ISBN 92-832-2414-0.
- Maciej Krzakowski, Piotr Potemski, Krzysztof Warzocha, Piotr Wysocki: Onkologia kliniczna. T. II. Via Medica, 2015. ISBN 978-83-7599-796-5.
- Andrew J. Wagner: Sarcoma, An Issue of Hematology/Oncology Clinics of North America. Elsevier Health Sciences, 2013. ISBN 978-0-323-26101-2.
