Efekty steryczne

Efekty steryczne – grupa stereochemicznych zjawisk wynikających z faktu, że atomy w cząsteczkach nie są punktami, lecz mają kształt zbliżony do sfery i zajmują określoną objętość w przestrzeni. Jeśli atomy zbliżają się do siebie na odległość mniejszą niż promienie ich sfer elektronowych, może dojść do reakcji chemicznej albo tylko do oddziaływań odpychających (zgodnie z regułą Pauliego), prowadzących do efektów sterycznych[1].
Zrozumienie efektów sterycznych miało kluczowe znaczenie w chemii, zwłaszcza chemii koordynacyjnej, katalizie, chemii polimerów, biochemii i farmakologii. Efekty steryczne są zjawiskiem powszechnym i w zasadzie występują w mniejszym lub większym stopniu w niemal wszystkich reakcjach chemicznych.
Zawada przestrzenna[edytuj | edytuj kod]

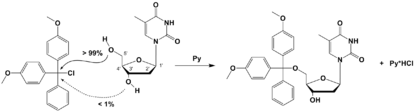
Zawada przestrzenna (steryczna) ma miejsce wtedy, gdy rozmiar grup funkcyjnych w cząsteczce uniemożliwia zajście reakcji chemicznej ze względu na brak dostępu atakującego indywiduum chemicznego do potencjalnego miejsca aktywnego.
Zawada przestrzenna jest często główną przeszkodą dla zajścia reakcji, jednak nie zawsze jest to zjawisko negatywne. Chemicy często celowo przyłączają grupy funkcyjne o dużej zawadzie (tak zwane grupy ochronne), by na przykład ochronić przyszłe miejsca aktywne w jednym z etapów syntezy, a także by zwiększyć odporność chemiczną końcowego produktu lub ułatwić jego wyodrębnienie przez zwiększenie lipofilowości. Najczęściej stosowane grupy ochronne o dużej zawadzie sterycznej to grupa mezytylowa, tert-butylowa (−C(CH
3)
3), izopropylowa (−CH(CH
3)
2), trimetylosililowa (−Si(CH
3)
3), tris(trimetylosililowa), zwana trisylem (−C[Si(CH
3)
3]
3), oraz pochodne grupy trifenylometylowej (trytylowej, −CPh
3).
Zawadą przestrzenną tłumaczy się także wymuszanie nietypowych kątów wiązań chemicznych, blokowanie rotacji wokół tych wiązań, wymuszanie ściśle określonej konformacji i inne podobne zjawiska występujące w stereochemii.
Osłona przestrzenna[edytuj | edytuj kod]
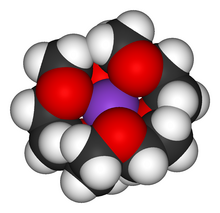
osłonięty eterem koronowym
Osłona przestrzenna (steryczna) ma miejsce wtedy, gdy jedna duża cząsteczka lub duży jon osłania inną, mniejszą cząsteczkę lub przeciwnie naładowany jon w taki sposób, że staje się ona częściowo lub całkowicie „niewidoczna” dla otoczenia.
Osłona przestrzenna występuje często w układach supramolekularnych, zwłaszcza w związkach kompleksowych, na przykład w układach eterów koronowych i innych kryptandów z jonami metali alkalicznych. Umożliwia to między innymi „przemycanie” tych jonów do środowiska, w którym się normalnie nie rozpuszczają. Zjawisko to jest wykorzystywane w katalizie przeniesienia fazowego.
Dopasowanie przestrzenne[edytuj | edytuj kod]
Dopasowanie przestrzenne występuje wtedy, gdy kształt i geometria jednej cząsteczki są tak skonstruowane, by do centrum reakcji dochodziły tylko cząsteczki o odpowiednim kształcie, dzięki czemu inne cząsteczki istniejące w układzie planowanej reakcji nie zakłócają jej przebiegu. Czasami taka selekcja steryczna wymusza też ściśle określoną izomerię produktu, co prowadzi do reakcji asymetrycznych, czyli prowadzących do otrzymania tylko jednego z wielu możliwych izomerów.
Mechanizm ten często występuje w naturze, gdzie jest podstawą działania wielu enzymów. Znajduje też zastosowanie w przemyśle chemicznym, między innymi przy projektowaniu katalizatorów wykazujących się dużą sterooselektywnością, na przykład Grubbsa III generacji i Zieglera-Natty[2].
Krzyżowanie łańcuchów[edytuj | edytuj kod]
Krzyżowanie łańcuchów to efekt steryczny obserwowany w chemii polimerów, polegający na zablokowaniu możliwości zmiany konformacji długich cząsteczek polimerów niezawierających dużych grup funkcyjnych wskutek tego, że są one splątane z innymi łańcuchami. Uważa się, że efekt ten powoduje wzrost temperatury mięknienia polimerów oraz znacząco zmienia ich właściwości mechaniczne[3].
Przypisy[edytuj | edytuj kod]
- ↑ Steric effect, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.S05997, ISBN 0-9678550-9-8 (ang.).
- ↑ Samuel H. Gellman. Introduction: Molecular Recognition. „Chemical Reviews”. 97 (5), s. 1231–1232, 1997. DOI: 10.1021/cr970328j. PMID: 11851448.
- ↑ Steric factor in polymers, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.S05999, ISBN 0-9678550-9-8 (ang.).
Bibliografia[edytuj | edytuj kod]
- J. March: Advanced Organic Chemistry. Wyd. 3. ISBN 0-471-85472-7.
