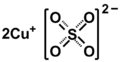Siarczan miedzi(I)
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny |
Cu2SO4 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
223,15 g/mol | ||||||||||||||||||
| Wygląd |
jasnoszare ciało stałe (produkt zawierający 1% Cu2O)[1] | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | |||||||||||||||||||
| PubChem | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Podobne związki | |||||||||||||||||||
| Inne aniony | |||||||||||||||||||
| Inne kationy | |||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||
Siarczan miedzi(I), nazwa Stocka: siarczan(VI) miedzi(I), Cu
2SO
4 – nieorganiczny związek chemiczny z grupy siarczanów metali, sól kwasu siarkowego i miedzi na I stopniu utlenienia.
Otrzymywanie[edytuj | edytuj kod]
Można go otrzymać w reakcji siarczanu dimetylu (CH
3)
2SO
4 z Cu
2O[3]. Metoda ta została opisana po raz pierwszy w 1909 roku[2][4]. Reakcja prowadzona w temperaturze 160 °C w atmosferze argonu daje produkt o wysokiej czystości (99%)[2][1]:
- (CH
3)
2SO
4 + Cu
2O → Cu
2SO
4 + (CH
3)
2O↑
Proces należy zakończyć po 10 minutach, gdyż kontynuowanie reakcji, nawet przez 2 minuty, prowadzi do stopniowego rozkładu związku[2][1].
Siarczan miedzi(I) otrzymywano też w wyniku redukcji siarczanu miedzi(II), np. dwutlenkiem siarki w trójskładnikowym siarczanowym stopie eutektycznym (Li
2SO
4, K
2SO
4, Na
2SO
4) w temperaturze 580 °C[5]:
- 2CuSO
4 + SO
2 → Cu
2SO
4 + 2SO
3
Właściwości[edytuj | edytuj kod]
Krystalizuje w układzie rombowym[2][1]. Przewodnictwo właściwe ciała stałego w temperaturze pokojowej wynosi 0,56 S/cm. Przewodnictwo to ma charakter jonowy, a przewodnictwo elektronowe jest na poziomie pomijalnym[6].
Jest związkiem wrażliwym na wilgoć, natomiast w suchym powietrzu jest trwały w temperaturze pokojowej. Z pomiarów przewodnictwa elektrycznego wynika, że powyżej 60 °C zaczyna ulegać rozkładowi (następuje gwałtowny wzrost oporu)[6]. Przy ogrzewaniu powyżej 320 °C ulega dysproporcjonowaniu do wielu produktów, reagujących następnie ze sobą. W zależności od warunków, sumaryczny zapis reakcji może być następujący[1]:
- 2Cu
2SO
4 → 2Cu
2O + 2SO
2↑ + O
2↑
lub
- 3Cu
2SO
4 → 2Cu
2O + SO
2↑ + 2CuSO
4
W roztworach wodnych także dysproporcjonuje, do siarczanu miedzi(II) i miedzi metalicznej[1][5]:
- Cu
2SO
4 → Cu↓ + CuSO
4
Z tlenkiem węgla i amoniakiem tworzy stabilne związki kompleksowe, odpowiednio [Cu(CO)]
2SO
4·H
2O i [Cu(NH
3)
2]
2SO
4[3], natomiast w reakcji z acetonitrylem powstaje nietrwały kompleks [Cu(CH
3CN)
4]
2SO
4[7].
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e f g H.J. Berthold, J. Born, Über Kupfer(I)-sulfat Cu2SO4. Darstellung und thermische Eigenschaften, „Zeitschrift für anorganische und allgemeine Chemie”, 550 (7), 1987, s. 7–15, DOI: 10.1002/zaac.19875500702 (niem.).
- ↑ a b c d e H.J. Berthold, J. Born, R. Wartchow, The crystal structure of copper(I)sulfate Cu2SO4. The first structure of a simple cuprous oxo-salt, „Zeitschrift für Kristallographie – Crystalline Materials”, 183 (1–4), 1988, s. 309–318, DOI: 10.1524/zkri.1988.183.14.309 (ang.).
- ↑ a b Philip John Durrant, Bryl Durrant, Zarys współczesnej chemii nieorganicznej, Warszawa: Państwowe Wydawnictwo Naukowe, 1965, s. 1218.
- ↑ A. Recoura, Sur le sulfate cuivreux, „Comptes rendus hebdomadaires des séances de l’Académie des sciences”, 148, 1909, s. 1105–1108 (fr.).
- ↑ a b R.I. Dearnaley, D.H. Kerridge, D.J. Rogers, Molten lithium sulfate-sodium sulfate-potassium sulfate eutectic: reactions of some sulfur compounds, „Inorganic Chemistry”, 22 (22), 1983, s. 3242–3247, DOI: 10.1021/ic00164a015 (ang.).
- ↑ a b M.A.K.L. Dissanayake, H.M.N. Bandara, Ionic conductivity of cuprous sulphate, „Electrochimica Acta”, 33 (4), 1988, s. 543–544, DOI: 10.1016/0013-4686(88)80174-9 (ang.).
- ↑ D.S. Gill i inni, Preparation, characterization, X-ray structure determination and solution properties of some novel copper(I) bisulfate and sulfate salts and their stable derivatives, „Zeitschrift fur Naturforschung B”, 66 (10), 2011, s. 1042–1048, DOI: 10.1515/znb-2011-1009 (ang.).