Tężec
| Tetanus | |
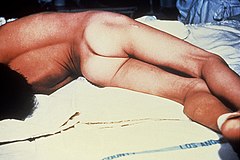 Opistotonus u pacjenta z tężcem | |
| Śmiertelność |
Różna w zależności od postaci (6–60%, u noworodków nawet do 90%)[1] |
|---|---|
| Czynnik chorobotwórczy | |
| Nazwa | |
| Epidemiologia | |
| Występowanie |
cały świat |
| Prawo | |
| Podlega zgłoszeniu WHO |
nie |
| Tetanus | |
 Szczękościsk u pacjenta chorującego na tężec |



Tężec (łac. tetanus) – ostra i ciężka choroba przyranna zwierząt[2]. Jest on chorobą zakaźną (wywoływana przez bakteryjny czynnik zakaźny), ale nie zaraźliwą, ponieważ jej przyczyną są egzotoksyny (o charakterze neurotoksyn) wytwarzane przez bakterię laseczkę tężca (Clostridium tetani).
Tężec występuje na całym świecie. Zwierzęciem najczęściej zapadającym na tężec jest koń, który jest też naturalnym nosicielem tejże choroby. Inne zwierzęta, jak choćby psy, koty, bydło i świnie są mniej wrażliwe. Natomiast ptaki są odporne. Bardzo podatny jest człowiek.
Tężec w krajach rozwiniętych jest rzadko występującą chorobą[2]. W Polsce w 1999 roku zarejestrowano 21, a w 2000 – 14 zachorowań[3].
Chorobę u ludzi i zwierząt powoduje Clostridium tetani, czyli Gram-dodatnia, beztlenowa orzęsiona laseczka występująca w ziemi i wytwarzająca organ przetrwalnikowy w postaci okrągłej endospory, umieszczonej na końcach laseczki[2][4].
Źródła zakażenia i patogeneza
[edytuj | edytuj kod]Przetrwalniki po wniknięciu w tkanki, najczęściej w miejscu przypadkowego urazu (jak np. oparzenia lub ukłucia[4]), przechodzą w postać wegetatywną poprzez proces kiełkowania przetrwalników. Rozwojowi sprzyjają warunki beztlenowe. Takie warunki spotykamy w ranach głębokich. W ranach płytkich i drobnych skaleczeniach może również dochodzić do namnażania się laseczek tężca pod warunkiem dodatkowego zakażenia drobnoustrojami tlenowymi, które zużywając tlen wytworzą warunki korzystne do rozwoju laseczek tężca. Namnażając się w miejscu zakażenia produkuje toksyny: tetanospazminę, tetanolizynę i fibrynolizynę.
Tetanospazmina jest neurotoksyną atakującą komórki nerwowe. Wiążąc się z obwodowym neuronem ruchowym, wnika do aksonu i stąd przenosi się do komórek nerwowych pnia mózgu i rdzenia kręgowego. Tetanospazmina wędruje następnie przez synapsę do zakończenia presynaptycznego, gdzie blokuje uwalnianie inhibitorów neuroprzekaźnikowych (glicyna i kwas gamma-aminomasłowy), co powoduje blokowanie fizjologicznych procesów hamowania i prowadzi do stałego nadmiernego pobudzenia neuronów ruchowych, które z kolei wywołuje wzmożone napięcie i napady prężeń (skurczów) mięśni szkieletowych.
Tetanolizyna działa litycznie na erytrocyty.
Objawy
[edytuj | edytuj kod]Okres inkubacji choroby wynosi od 2 do 21 dni[5]. Przed rozwojem pełnoobjawowej choroby występują objawy prodromalne, takie jak ból głowy, złe samopoczucie, bezsenność i niepokój, wzmożona potliwość i napięcie mięśni oraz parestezje lub ból w pobliżu rany[5]. Choroba przebiega w trzech postaciach[5][6]:
- uogólnionej (najczęściej) – głównym objawem są skurcze mięśni (najsilniejsze w pierwszych dwóch tygodniach), które wywołują opistotonus (łukowate wyprężenie ciała w stronę grzbietową z towarzyszącym wyprostem nóg i zgięciem rąk), szczękościsk oraz uśmiech sardoniczny, dysfagię, a w skrajnych przypadkach zatrzymanie oddechu[5]. Nagłe bodźce z otoczenia nasilają skurcze, które są bardzo bolesne[5]. Po kilku dniach pojawiają się zaburzenia funkcjonowania układu autonomicznego pod postacią zmian ciśnienia tętniczego i tętna, podwyższenia temperatury ciała, zatrzymania moczu, mydriasis oraz zaburzeń rytmu serca (arytmie aż do nagłego zatrzymania krążenia); są one główną przyczyną śmierci[5].
- miejscowej – stanowi ona zapowiedź wystąpienia tężca uogólnionego lub na jej etapie dochodzi do samoistnego wyleczenia na skutek powstania częściowej odporności przeciwko toksynom[5]. Objawy to skurcze mięśni w okolicy rany[5]. Niekiedy wyróżniany jest również tężec mózgowy, czyli z zajęciem wyłącznie nerwów czaszkowych, najczęściej nerwu twarzowego. Jest najrzadszą postacią tężca[6]. Występuje on zazwyczaj po uszkodzeniu skóry głowy (bardzo rzadko po urazach innych części ciała[7]), a jego częstym objawem jest osłabienie mięśni twarzy spowodowane uszkodzeniem dolnego neuronu ruchowego[5][8].
- noworodkowej – do jej rozwoju dochodzi u noworodków, które nie otrzymały swoistych przeciwciał od matki nieuodpornionej na tężec[5][9]. Jest to postać występująca najczęściej w krajach rozwijających się[5]. Pierwszy objaw tężca noworodkowego to niechęć do ssania, która przechodzi w bolesne skurcze mięśni i ich uogólnioną sztywność[10]. Śmiertelność tej postaci w przypadku niedostatecznej pomocy medycznej sięga 90%[1][11]. Jest ona główną (po odrze) przyczyną śmierci noworodków na całym świecie, której da się zapobiec szczepieniami[12].
Zmiany anatomopatologiczne
[edytuj | edytuj kod]W obrazie sekcyjnym brak jest charakterystycznych zmian.
Rozpoznawanie
[edytuj | edytuj kod]Rozpoznanie rozwiniętej choroby jest stosunkowo łatwe ze względu na występowanie charakterystycznych objawów klinicznych i wywiad chorobowy wskazujący na wcześniejsze zranienie z możliwością dostania się do rany przetrwalników tężca.
Rozpoznanie różnicowe
[edytuj | edytuj kod]W początkowych etapach choroby należy wykluczyć: zatrucie strychniną, tężyczkę, zapalenie mózgu, wściekliznę, ostry przebieg reumatoidalnego zapalenia stawów.
Leczenie zakażonych
[edytuj | edytuj kod]Zwierzęta
[edytuj | edytuj kod]Leczenie przeżuwaczy i świń nie daje efektów, w związku z tym zwierzęta te poddaje się ubojowi. U koni śmiertelność wynosi ponad 50%.
Człowiek
[edytuj | edytuj kod]Leczenie poprzez oczyszczenie zakażonego miejsca, podanie antytoksyny przeciwtężcowej. Leczenie ludzi odbywa się w warunkach szpitalnych, na oddziałach intensywnej opieki medycznej.
Postępowanie przeciwtężcowe
[edytuj | edytuj kod]Postępowanie zapobiegające zachorowaniu na tężec (postępowanie profilaktyczne) można podzielić na dwa zagadnienia:
- zapobieganie zachorowaniu osób zdrowych – uodpornienie czynne przez zastosowanie szczepień
- zapobieganie zachorowaniu u osób narażonych na zachorowanie przy podejrzeniu zanieczyszczenia rany (lub uszkodzenia ciągłości skóry/błon śluzowych) pałeczkami tężca lub ich przetrwalnikami – uodpornienie czynne lub czynno-bierne przez zastosowanie szczepienia lub szczepienia wraz z podaniem antytoksyny tężcowej.
Szczepienia przeciwtężcowe są łatwą, tanią i skuteczną formą zapobiegania zachorowaniom na tężec. Szczepienia stosuje się u ludzi, można także szczepić konie.
U ludzi szczepienia przeciw tężcowi należą do szczepień obowiązkowych, bezpłatnych.
Podstawowy program szczepień przeciwtężcowych, który powoduje wytworzenie odporności przed zachorowaniem składa się z 4 dawek podawanych w następujący sposób:
- 2. miesiąc życia (szczepionką skojarzoną, łącznie ze szczepieniem na błonicę i krztusiec – szczepionka DPT)
- przełom 3. i 4. miesiąca życia (po 6 tyg., szczepionką skojarzoną, łącznie ze szczepieniem na błonicę i krztusiec – szczepionka DPT)
- 5. miesiąc życia (szczepionką skojarzoną, łącznie ze szczepieniem na błonicę i krztusiec – szczepionka DPT)
- 16. – 18. miesiąc życia (szczepionką skojarzoną, łącznie ze szczepieniem na błonicę i krztusiec – szczepionka DPT).
Następnie należy przeprowadzać podawanie kolejnych dawek szczepionki, tzn. przypominających w następującym schemacie:
- 6. rok życia (szczepionką skojarzoną łącznie ze szczepieniem na błonicę i krztusiec – szczepionką DTaP)
- 14. rok życia (szczepionką skojarzoną łącznie ze szczepieniem na błonicę, ze zredukowaną ilością anatoksyny błoniczej)
- 19. rok życia (lub ostatni rok nauki w szkole) – (szczepionką skojarzoną łącznie ze szczepieniem na błonicę, ze zredukowaną ilością anatoksyny błoniczej).
Aby uchronić osobę dorosłą przed zachorowaniem, konieczne jest powtarzanie podawania dawek tej szczepionki (szczepionka Td) w odpowiednich odstępach czasu w ciągu całego życia, nie rzadziej niż co 10 lat.
Postępowanie z osobami zranionymi i narażonymi na zachorowanie na tężec zależy od: stanu przeprowadzenia programu szczepienia podstawowego, czasu, który upłynął od programu szczepienia podstawowego i ryzyka wystąpienia tężca.
Jeżeli ryzyko zachorowania jest duże, to u osób nieszczepionych, a także u których program podstawowy szczepienia nie został ukończony lub upłynęło więcej niż 10 lat od ukończenia programu podstawowego należy zastosować zarówno antytoksynę tężcową (ewent. ludzką immunoglobulinę przeciwtężcową) oraz szczepienia anatoksyną tężcową (szczepionka T lub Td) w schemacie 0-1-6 miesięcy.
Klasyfikacja ICD10
[edytuj | edytuj kod]| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: A33 | Tężec noworodków |
| ICD-10: A34 | Tężec położniczy |
| ICD-10: A35 | Inne postacie tężca |
Zobacz też
[edytuj | edytuj kod]Przypisy
[edytuj | edytuj kod]- ↑ a b Szczeklik i Gajewski 2017 ↓, s. 2390.
- ↑ a b c Ingo Stock, [Tetanus and Clostridium tetani--a brief review], „Medizinische Monatsschrift Fur Pharmazeuten”, 38 (2), 2015, s. 57–60, ISSN 0342-9601, PMID: 26376540 [dostęp 2018-04-21].
- ↑ Przegląd Epidemiol 2002;56:335-8. [dostęp 2007-12-15]. [zarchiwizowane z tego adresu (2007-12-11)].
- ↑ a b Yoshitaka Tomoda i inni, Tetanus without apparent history of trauma, „Journal of General and Family Medicine”, 19 (2), 2018, s. 61–62, DOI: 10.1002/jgf2.153, ISSN 2189-6577, PMID: 29600132, PMCID: PMC5867140 [dostęp 2018-04-21].
- ↑ a b c d e f g h i j k Szczeklik i Gajewski 2017 ↓, s. 2388.
- ↑ a b Robert A. Felter, Lauren E. Zinns, Cephalic Tetanus in an Immunized Teenager: An Unusual Case Report, „Pediatric Emergency Care”, 31 (7), 2015, s. 511–513, DOI: 10.1097/PEC.0000000000000360, ISSN 1535-1815, PMID: 25853723 [dostęp 2018-04-22].
- ↑ Jae-Cheol Kwon i inni, Trismus in cephalic tetanus from a foot injury, „The Korean Journal of Internal Medicine”, 28 (1), 2013, s. 121, DOI: 10.3904/kjim.2013.28.1.121, ISSN 1226-3303, PMID: 23346010, PMCID: PMC3543954 [dostęp 2018-04-22].
- ↑ Josie McCabe, Tessa La Varis, Deborah Mason, Cephalic tetanus complicating geriatric fall, „The New Zealand Medical Journal”, 127 (1400), 2014, s. 98–100, ISSN 1175-8716, PMID: 25145370 [dostęp 2018-04-22].
- ↑ Vittorio Demicheli, Antonella Barale, Alessandro Rivetti, Vaccines for women for preventing neonatal tetanus, „The Cochrane Database of Systematic Reviews” (7), 2015, CD002959, DOI: 10.1002/14651858.CD002959.pub4, ISSN 1469-493X, PMID: 26144877 [dostęp 2018-04-22].
- ↑ Hannah Blencowe i inni, Tetanus toxoid immunization to reduce mortality from neonatal tetanus, „International Journal of Epidemiology”, 39 (Suppl 1), 2010, i102–i109, DOI: 10.1093/ije/dyq027, ISSN 0300-5771, PMID: 20348112, PMCID: PMC2845866 [dostęp 2018-04-21].
- ↑ Maternal and neonatal tetanus elimination: validation survey in 4 States in India, April 2013, „Releve Epidemiologique Hebdomadaire”, 89 (18), 2014, s. 177–188, ISSN 0049-8114, PMID: 24864342 [dostęp 2018-04-22].
- ↑ Adeel Ahmed Khan, Aysha Zahidie, Fauziah Rabbani, Interventions to reduce neonatal mortality from neonatal tetanus in low and middle income countries – a systematic review, „BMC Public Health”, 13, 2013, s. 322, DOI: 10.1186/1471-2458-13-322, ISSN 1471-2458, PMID: 23570611, PMCID: PMC3637612 [dostęp 2018-04-22].
Bibliografia
[edytuj | edytuj kod]- Choroby zakaźne i pasożytnicze. Zdzisław Dziubek (red.). Wyd. III uaktualnione. Warszawa: Wydawnictwo Lekarskie PZWL, 2003, s. 110–113. ISBN 83-200-2748-9.
- Andrzej Szczeklik, Piotr Gajewski: Interna Szczeklika 2017. Kraków: Wydawnictwo Medycyna Praktyczna, 2017, s. 2388–2390. ISBN 978-83-7430-517-4.
