Dysplazja włóknisto-mięśniowa: Różnice pomiędzy wersjami
| [wersja przejrzana] | [wersja przejrzana] |
m Bot poprawia linki |
m zamieniam magiczny PMID na dedykowane pole w szablonie cytowania |
||
| Linia 17: | Linia 17: | ||
|MeshYear = |
|MeshYear = |
||
}} |
}} |
||
[[Plik:Fibr.jpg|Dysplazja włóknisto-mięśniowa tętnicy nerkowej przebiegająca z zajęciem tętnic segmentalnych w angiografii. Charakterystyczny obraz „sznura pereł” spowodowany jest odcinkami zwężeń oddzielających niewielkie tętniakowate poszerzenia, przekraczające prawidłową średnicę naczynia<ref name=plouin>{{Cytuj pismo|autor=Plouin PF, Perdu J, La Batide-Alanore A, Boutouyrie P, Gimenez-Roqueplo AP, Jeunemaitre X|tytuł=Fibromuscular dysplasia|czasopismo=Orphanet Journal of Rare Diseases|rok=2007|url=http://www.ojrd.com/content/2/1/28|oznaczenie=2|wolumin=28| |
[[Plik:Fibr.jpg|Dysplazja włóknisto-mięśniowa tętnicy nerkowej przebiegająca z zajęciem tętnic segmentalnych w angiografii. Charakterystyczny obraz „sznura pereł” spowodowany jest odcinkami zwężeń oddzielających niewielkie tętniakowate poszerzenia, przekraczające prawidłową średnicę naczynia<ref name=plouin>{{Cytuj pismo|autor=Plouin PF, Perdu J, La Batide-Alanore A, Boutouyrie P, Gimenez-Roqueplo AP, Jeunemaitre X|tytuł=Fibromuscular dysplasia|czasopismo=Orphanet Journal of Rare Diseases|rok=2007|url=http://www.ojrd.com/content/2/1/28|oznaczenie=2|wolumin=28|pmid=17555581}}</ref>|thumb]] |
||
'''Dysplazja włóknisto-mięśniowa''' ([[język angielski|ang.]] ''fibromuscular dysplasia, FMD, fibromuscular fibroplasia'') – grupa [[miażdżyca|niemiażdżycowych]], [[zapalenie|niezapalnych]] chorób naczyń [[tętnica|tętniczych]], przede wszystkim [[Tętnica nerkowa|tętnic nerkowych]] i [[Tętnica szyjna|szyjnych]]. Częstość objawowej dysplazji włóknisto-mięśniowej naczyń nerkowych szacuje się na 4:1000, a częstość naczyń szyjnych i mózgowych jest przypuszczalnie o połowę mniejsza. |
'''Dysplazja włóknisto-mięśniowa''' ([[język angielski|ang.]] ''fibromuscular dysplasia, FMD, fibromuscular fibroplasia'') – grupa [[miażdżyca|niemiażdżycowych]], [[zapalenie|niezapalnych]] chorób naczyń [[tętnica|tętniczych]], przede wszystkim [[Tętnica nerkowa|tętnic nerkowych]] i [[Tętnica szyjna|szyjnych]]. Częstość objawowej dysplazji włóknisto-mięśniowej naczyń nerkowych szacuje się na 4:1000, a częstość naczyń szyjnych i mózgowych jest przypuszczalnie o połowę mniejsza. |
||
| Linia 23: | Linia 23: | ||
== Historia == |
== Historia == |
||
Dysplazję włóknisto-mięśniową tętnic opisali pierwsi Leadbetter i Burkland w 1938 roku u 5-letniego chłopca jako chorobę tętnic nerkowych<ref>{{Cytuj pismo|autor=Leadbetter WF, Burkland CD|tytuł=Hypertension in unilateral renal disease|czasopismo=J Urol|rok=1938|oznaczenie=39|strony=611-26}}</ref>. Zajęcie naczyń tętniczych czaszkowo-szyjnych opisali w 1946 roku Palubinskas i Ripley<ref>{{Cytuj pismo|autor=Palubinskas AJ, Ripley HR|tytuł=Fibromuscular hyperplasia in extrarenal arteries|czasopismo=Radiology|rok=1946|oznaczenie=82|strony=451-55}}</ref>. W 1958 roku McCormack i wsp. przedstawili obserwacje histopatologiczne nad zmienionymi tętnicami nerkowymi u czterech pacjentów z nadciśnieniem nerkopochodnym i stwierdzili hiperplazję komórek naczynia<ref>{{Cytuj pismo|autor=McCormack LJ, Hazard JB, Poutasse EF|tytuł=Obstructive lesions of renal artery associated with remediable hypertension|czasopismo=Am J Pathol|rok=1958|oznaczenie=34|strony=582}}</ref>. W 1965 roku Hunt i wsp. stwierdzili heterogeniczność choroby i wprowadzili termin dysplazji włóknisto-mięśniowej w miejsce używanej wcześniej nazwy hiperplazji włóknisto-mięśniowej<ref name=hunt>{{Cytuj pismo|autor=Hunt J, Harrison EG, Sheps SG, Bernatz PE, Davis GD|tytuł=Hypertension caused by fibromuscular dyplasia of renal arteries|czasopismo=Postgrad Med|rok=1965|oznaczenie=38|strony=53-63| |
Dysplazję włóknisto-mięśniową tętnic opisali pierwsi Leadbetter i Burkland w 1938 roku u 5-letniego chłopca jako chorobę tętnic nerkowych<ref>{{Cytuj pismo|autor=Leadbetter WF, Burkland CD|tytuł=Hypertension in unilateral renal disease|czasopismo=J Urol|rok=1938|oznaczenie=39|strony=611-26}}</ref>. Zajęcie naczyń tętniczych czaszkowo-szyjnych opisali w 1946 roku Palubinskas i Ripley<ref>{{Cytuj pismo|autor=Palubinskas AJ, Ripley HR|tytuł=Fibromuscular hyperplasia in extrarenal arteries|czasopismo=Radiology|rok=1946|oznaczenie=82|strony=451-55}}</ref>. W 1958 roku McCormack i wsp. przedstawili obserwacje histopatologiczne nad zmienionymi tętnicami nerkowymi u czterech pacjentów z nadciśnieniem nerkopochodnym i stwierdzili hiperplazję komórek naczynia<ref>{{Cytuj pismo|autor=McCormack LJ, Hazard JB, Poutasse EF|tytuł=Obstructive lesions of renal artery associated with remediable hypertension|czasopismo=Am J Pathol|rok=1958|oznaczenie=34|strony=582}}</ref>. W 1965 roku Hunt i wsp. stwierdzili heterogeniczność choroby i wprowadzili termin dysplazji włóknisto-mięśniowej w miejsce używanej wcześniej nazwy hiperplazji włóknisto-mięśniowej<ref name=hunt>{{Cytuj pismo|autor=Hunt J, Harrison EG, Sheps SG, Bernatz PE, Davis GD|tytuł=Hypertension caused by fibromuscular dyplasia of renal arteries|czasopismo=Postgrad Med|rok=1965|oznaczenie=38|strony=53-63|pmid=14314048}}</ref>. |
||
== Epidemiologia == |
== Epidemiologia == |
||
Wczesne wyniki badań [[sekcja zwłok|autopsyjnych]] i radiologicznych sugerowały, że częstość FMD naczyń szyjno-czaszkowych wynosi około 1% populacji, ale nowsze badania szacują ją na 0,02%.<ref name=schievink1996>{{Cytuj pismo|autor=Schievink WI, Bjornsson J|tytuł=Fibromuscular dysplasia of the internal carotid artery: a clinicopathological study|czasopismo=Clin Neuropathol|rok=1996|oznaczenie=15|wolumin=1|strony=2-6}}</ref> Uważa się, że 10-20% zwężeń tętnic nerkowych jest konsekwencją FMD; ponieważ nadciśnienie nerkopochodne odpowiada za mniej niż 1-2% przypadków nadciśnienia, można przypuszczać, że istotna klinicznie FMD tętnic nerkowych występuje z częstością 0,4% populacji. Bezobjawowa dysplazja włóknisto-mięśniowa jest przypuszczalnie rząd wielkości częstsza; w czterech dużych badaniach angiograficznych<ref name=spring>{{Cytuj pismo|autor=Spring DB, Salvatierra O Jr, Palubinskas AJ, Amend WJ Jr, Vincenti FG, Feduska NJ|tytuł=Results and significance of angiography in potential kidney donors|czasopismo=Radiology|rok=1979|oznaczenie=133|strony=45-47}}</ref><ref name=cragg>{{Cytuj pismo|autor=Cragg AH, Smith TP, Thompson BH, Maroney TP, Stanson AW, Shaw GT, Hunter DW, Cochran ST|tytuł=Incidental fibromuscular dysplasia in potential renal donors: long-term clinical follow-up|czasopismo=Radiology|rok=1989|oznaczenie=172|strony=145-147|id=P|url=http://radiology.rsnajnls.org/cgi/reprint/172/1/145}}</ref><ref name=neymark>{{Cytuj pismo|autor=Neymark E, LaBerge JM, Hirose R, Melzer JS, Kerlan RK Jr, Wilson MW, Gordon RL|tytuł=Arteriographic detection of renovascular disease in potential renal donors: incidence and effect on donor surgery|czasopismo=Radiology|rok=2000|oznaczenie=214|strony=755-760| |
Wczesne wyniki badań [[sekcja zwłok|autopsyjnych]] i radiologicznych sugerowały, że częstość FMD naczyń szyjno-czaszkowych wynosi około 1% populacji, ale nowsze badania szacują ją na 0,02%.<ref name=schievink1996>{{Cytuj pismo|autor=Schievink WI, Bjornsson J|tytuł=Fibromuscular dysplasia of the internal carotid artery: a clinicopathological study|czasopismo=Clin Neuropathol|rok=1996|oznaczenie=15|wolumin=1|strony=2-6}}</ref> Uważa się, że 10-20% zwężeń tętnic nerkowych jest konsekwencją FMD; ponieważ nadciśnienie nerkopochodne odpowiada za mniej niż 1-2% przypadków nadciśnienia, można przypuszczać, że istotna klinicznie FMD tętnic nerkowych występuje z częstością 0,4% populacji. Bezobjawowa dysplazja włóknisto-mięśniowa jest przypuszczalnie rząd wielkości częstsza; w czterech dużych badaniach angiograficznych<ref name=spring>{{Cytuj pismo|autor=Spring DB, Salvatierra O Jr, Palubinskas AJ, Amend WJ Jr, Vincenti FG, Feduska NJ|tytuł=Results and significance of angiography in potential kidney donors|czasopismo=Radiology|rok=1979|oznaczenie=133|strony=45-47}}</ref><ref name=cragg>{{Cytuj pismo|autor=Cragg AH, Smith TP, Thompson BH, Maroney TP, Stanson AW, Shaw GT, Hunter DW, Cochran ST|tytuł=Incidental fibromuscular dysplasia in potential renal donors: long-term clinical follow-up|czasopismo=Radiology|rok=1989|oznaczenie=172|strony=145-147|id=P|url=http://radiology.rsnajnls.org/cgi/reprint/172/1/145}}</ref><ref name=neymark>{{Cytuj pismo|autor=Neymark E, LaBerge JM, Hirose R, Melzer JS, Kerlan RK Jr, Wilson MW, Gordon RL|tytuł=Arteriographic detection of renovascular disease in potential renal donors: incidence and effect on donor surgery|czasopismo=Radiology|rok=2000|oznaczenie=214|strony=755-760|pmid=10715042|url=http://radiology.rsnajnls.org/cgi/content/full/214/3/755}}</ref><ref name=andreoni>{{Cytuj pismo|autor=Andreoni KA, Weeks SM, Gerber DA, Fair JH, Mauro MA, McCoy L, Scott L, Johnson MW|tytuł=Incidence of donor renal fibromuscular dysplasia: does it justify routine angiography?|czasopismo=Transplantation|rok=2002|oznaczenie=73|strony=1112-1116|pmid=11965042}}</ref> łącznie 3181 potencjalnych dawców nerek FMD zdiagnozowano u 139 z nich, co daje częstość 4,4%<ref name=plouin/>. |
||
== Klasyfikacja == |
== Klasyfikacja == |
||
[[Plik:Renal artery angiography in a patient with fibromuscular dysplasia (1).jpg|FMD dodatkowej lewej dolnej tętnicy nerkowej u 35-letniej kobiety z nadciśnieniem. Dwie strzałki wskazują zmieniony odcinek tętnicy; grot trzeciej strzałki pokazuje workowatego tętniaka prawej tętnicy nerkowej<ref name=zeina>{{Cytuj pismo|autor=Zeina AR, Vladimir W, Barmeir E|tytuł=Fibromuscular dysplasia in an accessory renal artery causing renovascular hypertension: a case report|czasopismo=Journal of Medical Case Reports|rok=2007|oznaczenie=1|wolumin=58| |
[[Plik:Renal artery angiography in a patient with fibromuscular dysplasia (1).jpg|FMD dodatkowej lewej dolnej tętnicy nerkowej u 35-letniej kobiety z nadciśnieniem. Dwie strzałki wskazują zmieniony odcinek tętnicy; grot trzeciej strzałki pokazuje workowatego tętniaka prawej tętnicy nerkowej<ref name=zeina>{{Cytuj pismo|autor=Zeina AR, Vladimir W, Barmeir E|tytuł=Fibromuscular dysplasia in an accessory renal artery causing renovascular hypertension: a case report|czasopismo=Journal of Medical Case Reports|rok=2007|oznaczenie=1|wolumin=58|pmid=17672905|url=http://www.jmedicalcasereports.com/content/1/1/58}}</ref>|thumb]] |
||
[[Plik:Renal artery angiography in a patient with fibromuscular dysplasia (2).jpg|Wybiórcza angiografia dodatkowej tętnicy nerkowej u tej samej pacjentki po zakończonym sukcesem zabiegu przezskórnej angioplastyki balonowej<ref name=zeina/>|thumb]] |
[[Plik:Renal artery angiography in a patient with fibromuscular dysplasia (2).jpg|Wybiórcza angiografia dodatkowej tętnicy nerkowej u tej samej pacjentki po zakończonym sukcesem zabiegu przezskórnej angioplastyki balonowej<ref name=zeina/>|thumb]] |
||
Klasyfikacja histologiczna schorzenia (zaproponowana przez McCormack i wsp.<ref>{{Cytuj pismo|autor=McCormack LJ, Poutasse EF, Meaney TF, Noto TJ Jr, Dustan HP|tytuł=A pathologic-arteriographic correlation of renal arterial disease|czasopismo=Am Heart J|rok=1966|oznaczenie=72|strony=188-198| |
Klasyfikacja histologiczna schorzenia (zaproponowana przez McCormack i wsp.<ref>{{Cytuj pismo|autor=McCormack LJ, Poutasse EF, Meaney TF, Noto TJ Jr, Dustan HP|tytuł=A pathologic-arteriographic correlation of renal arterial disease|czasopismo=Am Heart J|rok=1966|oznaczenie=72|strony=188-198|pmid=5915557}}</ref><ref>{{Cytuj pismo|autor=Harrison EG Jr, McCormack LJ|tytuł=Pathologic classification of renal arterial disease in renovascular hypertension|czasopismo=Mayo Clin Proc|rok=1971|oznaczenie=46|strony=161-167|pmid=5553126}}</ref> poprawiona przez Stanleya<ref>{{cytuj książkę|autor=Stanley JC|rozdział=Renal artery fibrodysplasia|tytuł=Renal Vascular Disease|inni=Novick AC, Scable J, Hamilton G (ed.)|miejsce=London|wydawca=WB Saunders|rok=1996|strony=21-23}}</ref>) wyróżnia trzy główne typy: |
||
* z zajęciem błony wewnętrznej (ang. ''intimal type'') |
* z zajęciem błony wewnętrznej (ang. ''intimal type'') |
||
* środkowej (ang. ''medial type'') |
* środkowej (ang. ''medial type'') |
||
| Linia 58: | Linia 58: | ||
== Etiologia == |
== Etiologia == |
||
[[Plik:CTA FMD.jpg|Obraz FMD tętnic nerkowych w angio-CT<ref name=plouin/>|thumb]] |
[[Plik:CTA FMD.jpg|Obraz FMD tętnic nerkowych w angio-CT<ref name=plouin/>|thumb]] |
||
Przypuszczalnie w etiologii FMD mają udział czynniki genetyczne. Donoszono o możliwym związku FMD z [[mutacja]]mi w genie [[kolagen]]u<ref name=tromp>{{Cytuj pismo|autor=Tromp G, Wu Y, Prockop DJ, Madhatheri SL, Kleinert C, Earley JJ, Zhuang J, Norrgård O, Darling RC, Abbott WM, et al|tytuł=Sequencing of cDNA from 50 unrelated patients reveals that mutations in the triple-helical domain of type III procollagen are an infrequent causeof aortic aneurysms|czasopismo=J Clin Invest|rok=1993|oznaczenie=91|wolumin=6|strony=2539-45| |
Przypuszczalnie w etiologii FMD mają udział czynniki genetyczne. Donoszono o możliwym związku FMD z [[mutacja]]mi w genie [[kolagen]]u<ref name=tromp>{{Cytuj pismo|autor=Tromp G, Wu Y, Prockop DJ, Madhatheri SL, Kleinert C, Earley JJ, Zhuang J, Norrgård O, Darling RC, Abbott WM, et al|tytuł=Sequencing of cDNA from 50 unrelated patients reveals that mutations in the triple-helical domain of type III procollagen are an infrequent causeof aortic aneurysms|czasopismo=J Clin Invest|rok=1993|oznaczenie=91|wolumin=6|strony=2539-45|pmid=8514866|url=http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=8514866}}</ref> ze skórą wiotką (''cutis laxa'')<ref name=mckusick>{{cytuj książkę|autor=McKusick VA|tytuł=Heritable Disorders of Connective Tissue|edycja=4th ed|miejsce=St Louis|wydawca=Mosby-Yearbook|rok=1972|strony=382-6}}</ref> i niedoborem [[alfa1-antytrypsyna|α<sub>1</sub>-antytrypsyny]]<ref name=schievinkneuro>{{Cytuj pismo|autor=Schievink WI, Meyer FB, Parisi JE, Wijdicks EF|tytuł=Fibromuscular dysplasia of the internal carotid artery associated with alpha1-antitrypsin deficiency|czasopismo=Neurosurgery|rok=1998|oznaczenie=43|wolumin=2|strony=229-33|pmid=9696074}}</ref>. Donoszono o pojedynczych przypadkach występowania FMD u pacjentów z [[zespół Marfana|zespołem Marfana]]<ref>{{Cytuj pismo|autor=Schievink WI, Bjornsson J, Piepgras DG|tytuł=Coexistence of fibromuscular dysplasia and cystic medial necrosis in a patient with Marfan’s syndrome and bilateral carotid artery dissections|czasopismo=Stroke|rok=1994|oznaczenie=25|strony=2492-2496}}</ref> [[nerwiakowłókniakowatość|nerwiakowłókniakowatością]], [[zespół Alporta|zespołem Alporta]]<ref>{{Cytuj pismo|autor=Hudgins LB, Limbacher JP|tytuł=Fibromuscular dysplasia in Alport’s syndrome|czasopismo=J Tenn Med Assoc|rok=1982|oznaczenie=75|strony=733-735|pmid=7176628}}</ref> [[zespół Takayasu|zapaleniem naczyń Takayasu]]<ref name=janzen>{{Cytuj pismo|autor=Janzen J, Vuong PN, Rothenberger-Janzen K|tytuł=Takayasu’s arteritis and fibromuscular dysplasia as causes of acquired atypical coarctation of the aorta: retrospective analysis of seven cases|czasopismo=Heart Vessels|rok=1999|oznaczenie=14|strony=277-282|pmid=10901482}}</ref><ref name=d'souza>{{Cytuj pismo|autor=D’Souza SJ, Tsai WS, Silver MM, et al|tytuł=Diagnosis and management of stenotic aorto-arteriopathy in childhood|czasopismo=J Pediatr|rok=1998|oznaczenie=132|strony=1016-1022|pmid=9627596}}</ref> i [[Guz chromochłonny|guzem chromochłonnym]]<ref name=gray>{{cytuj książkę|autor=Gray GH, Young JR, Olin JW|rozdział=Miscellaneous arterial diseases|inni=Young JR, Olin JW, Bartholomew J (red.)|tytuł=Peripheral Vascular Diseases|edycja=2nd ed|miejsce=St Louis|wydawca=Mosby-Yearbook|rok=1996|strony=425-40}}</ref><ref name=qunibi>{{Cytuj pismo|autor=Qunibi WJ, Taylor TK, Knight TF, Senekjian HO, Gomez L, Weinman EJ|tytuł=Pheochromocytoma and fibromuscular hyperplasia|czasopismo=South Med J|rok=1979|oznaczenie=72|strony=1481-1482|pmid=505091}}</ref><ref name=mendonca>{{Cytuj pismo|autor=de Mendonca WC, Espat PA|tytuł=Pheochromocytoma associated with arterial fibromuscular dysplasia|czasopismo=Am J Clin Pathol|rok=1981|oznaczenie=75|strony=749-754|pmid=7234761}}</ref>. |
||
Udział czynników środowiskowych nie jest jasny; w kilku badaniach stwierdzono, że pacjenci z FMD częściej palą [[papieros]]y<ref name=luscher>{{Cytuj pismo|autor=Luscher TF, Lie JT, Stanson AW, Houser OW, Hollier LH, Sheps SG|tytuł=Arterial fibromuscular dysplasia|czasopismo=Mayo Clin Proc|rok=1987|oznaczenie=62|strony=931-952| |
Udział czynników środowiskowych nie jest jasny; w kilku badaniach stwierdzono, że pacjenci z FMD częściej palą [[papieros]]y<ref name=luscher>{{Cytuj pismo|autor=Luscher TF, Lie JT, Stanson AW, Houser OW, Hollier LH, Sheps SG|tytuł=Arterial fibromuscular dysplasia|czasopismo=Mayo Clin Proc|rok=1987|oznaczenie=62|strony=931-952|pmid=3309488}}</ref><ref name=nicholson>{{Cytuj pismo|autor=Nicholson JP, Teichman SL, Alderman MH, Sos TA, Pickering TG, Laragh JH|tytuł=Cigarette smoking and renovascular hypertension|czasopismo=[[The Lancet|Lancet]]|rok=1983|oznaczenie=2|strony=765-766|pmid=6137603}}</ref><ref name=sang>{{Cytuj pismo|autor=Sang CN, Whelton PK, Hamper UM, Connolly M, Kadir S, White RI, Sanders R, Liang KY, Bias W|tytuł=Etiologic factors in renovascular fibromuscular dysplasia. A case-control study|czasopismo=Hypertension|rok=1989|oznaczenie=14|strony=472-479|pmid=2680961}}</ref>, a u tych, którzy palą, przebieg choroby jest cięższy<ref name=bofinger>{{Cytuj pismo|autor=Bofinger A, Hawley C, Fisher P, Daunt N, Stowasser M, Gordon R|tytuł=Increased severity of multifocal renal arterial fibromuscular dysplasia in smokers|czasopismo=J Hum Hypertens|rok=1999|oznaczenie=13|strony=517-520|pmid=10455472}}</ref>. Nie określono jednak mechanizmów jakie miałyby wywoływać FMD u palaczy<ref name=plouin/>. Częstsze występowanie FMD u kobiet sugeruje udział ekspozycji na endogenne albo egzogenne estrogeny w predyspozycji do FMD, ale liczba ciąży i częstość stosowania antykoncepcji hormonalnej w grupie pacjentek z FMD nie różni się znacząco od grupy kontrolnej<ref name=luscher/><ref name=sang/>. |
||
== Objawy i przebieg == |
== Objawy i przebieg == |
||
{|class=toccolours align="right" style="margin:0 0 0.5em 1em;" |
{|class=toccolours align="right" style="margin:0 0 0.5em 1em;" |
||
!colspan="2" style="background:#87CEFA"| Obrazy FMD w USG<ref name=arning>{{Cytuj pismo|autor=Arning C, Grzyska U|tytuł=Color Doppler imaging of cervicocephalic fibromuscular dysplasia|czasopismo=Cardiovascular Ultrasound|rok=2004|oznaczenie=2|wolumin=7| |
!colspan="2" style="background:#87CEFA"| Obrazy FMD w USG<ref name=arning>{{Cytuj pismo|autor=Arning C, Grzyska U|tytuł=Color Doppler imaging of cervicocephalic fibromuscular dysplasia|czasopismo=Cardiovascular Ultrasound|rok=2004|oznaczenie=2|wolumin=7|pmid=15265239}}</ref> |
||
|- |
|- |
||
|width="100"| Objaw „sznura pereł” w kolorowym doplerze u 51-letniej kobiety z zawężającą FMD wewnętrznej tętnicy szyjnej niskiego stopnia. |
|width="100"| Objaw „sznura pereł” w kolorowym doplerze u 51-letniej kobiety z zawężającą FMD wewnętrznej tętnicy szyjnej niskiego stopnia. |
||
| Linia 83: | Linia 83: | ||
|} |
|} |
||
; FMD tętnic nerkowych: |
; FMD tętnic nerkowych: |
||
Najczęstszą manifestacją FMD jest [[nadciśnienie tętnicze|nadciśnienie tętnicze nerkopochodne]] wtórne do zwężenia [[tętnica nerkowa|tętnicy nerkowej]]<ref name=plouin/>. Stenoza naczynia spowodowana dysplazją włóknisto-mięśniową może skutkować nadciśnieniem każdego stopnia, ale najczęściej jest wykrywana u pacjentów z II i III stopniem choroby nadciśnieniowej, z nadciśnieniem o nagłym początku lub nadciśnieniem złośliwym. W górnym kwadrancie brzucha lub w boku pacjenta można stwierdzić osłuchiwaniem szmer naczyniowy<ref name=pannier>{{Cytuj pismo|autor=Pannier-Moreau I, Grimbert P, Fiquet-Kempf B, Vuagnat A, Jeunemaitre X, Corvol P, Plouin PF|tytuł=Possible familial origin of multifocal renal artery fibromuscular dysplasia|czasopismo=J Hypertens|rok=1997|oznaczenie=15|strony=1797-801}}</ref>, ale [[Czułość testu diagnostycznego|czułość]] i [[Swoistość testu diagnostycznego|specyficzność]] tego objawu są ograniczone<ref name=turnbull>{{Cytuj pismo|autor=Turnbull JM|tytuł=Is listening for abdominal bruits useful in the evaluation of hypertension?|czasopismo=[[Journal of the American Medical Association|JAMA]]|rok=1995|oznaczenie=274|strony=1299-1301| |
Najczęstszą manifestacją FMD jest [[nadciśnienie tętnicze|nadciśnienie tętnicze nerkopochodne]] wtórne do zwężenia [[tętnica nerkowa|tętnicy nerkowej]]<ref name=plouin/>. Stenoza naczynia spowodowana dysplazją włóknisto-mięśniową może skutkować nadciśnieniem każdego stopnia, ale najczęściej jest wykrywana u pacjentów z II i III stopniem choroby nadciśnieniowej, z nadciśnieniem o nagłym początku lub nadciśnieniem złośliwym. W górnym kwadrancie brzucha lub w boku pacjenta można stwierdzić osłuchiwaniem szmer naczyniowy<ref name=pannier>{{Cytuj pismo|autor=Pannier-Moreau I, Grimbert P, Fiquet-Kempf B, Vuagnat A, Jeunemaitre X, Corvol P, Plouin PF|tytuł=Possible familial origin of multifocal renal artery fibromuscular dysplasia|czasopismo=J Hypertens|rok=1997|oznaczenie=15|strony=1797-801}}</ref>, ale [[Czułość testu diagnostycznego|czułość]] i [[Swoistość testu diagnostycznego|specyficzność]] tego objawu są ograniczone<ref name=turnbull>{{Cytuj pismo|autor=Turnbull JM|tytuł=Is listening for abdominal bruits useful in the evaluation of hypertension?|czasopismo=[[Journal of the American Medical Association|JAMA]]|rok=1995|oznaczenie=274|strony=1299-1301|pmid=7563536}}</ref>. Powikłania nerkowej dysplazji włóknisto-mięśniowej obejmują rozwarstwienie tętnicy nerkowej objawiające się gwałtownym bólem w boku, [[hematuria|krwiomoczem]] i gwałtownie rosnącym nadciśnieniem<ref name=paris>{{Cytuj pismo|autor= Paris B, Bobrie G, Rossignol P, Le Coz S, Chedid A, Plouin PF|tytuł=Blood pressure and renal outcomes in patients with kidney infarction and hypertension|czasopismo=J Hypertens|rok=2006|oznaczenie=24|strony=1649-1654|wolumin=8|pmid=16877969}}</ref>. Jako skutek aktywacji [[Układ renina–angiotensyna–aldosteron|układu renina-angiotensyna-aldosteron]] u pacjenta może rozwinąć się [[hipokaliemia]] odzwierciedlająca wtórny [[hiperaldosteronizm]], szczególnie w przypadkach powikłanych rozwarstwieniem tętnicy nerkowej i zawałem nerki<ref name=paris/><ref name=plouinbook>{{cytuj książkę|autor=Plouin PF, Corvol P|rozdział=Renin-angiotensin II-related hypertension|tytuł=Endocrinology|inni=Pinchera A (ed.)|wydawca=McGraw-Hill Clinical Medicine Series|rok=2001|strony=355-60}}</ref>. W przeciwieństwie do miażdżycowych zwężeń tętnicy nerkowej, nerkowa FMD rzadko wiąże się z podwyższonymi poziomami [[kreatynina|kreatyniny]] w osoczu. |
||
; FMD naczyń szyjnych: |
; FMD naczyń szyjnych: |
||
Dysplazja włóknisto-mięśniowa tętnic szyjnych, dotycząca przede wszystkim [[tętnica szyjna wewnętrzna|tętnicy szyjnej wewnętrznej]], rzadko jest objawowa<ref name=plouin/>. Może być wykryta przypadkowo podczas badania dopplerowskiego naczyń szyjnych u pacjentów z zawrotami głowy, bólami głowy lub bezobjawowym szmerem naczyniowym nad szyją<ref name=mettiger>{{Cytuj pismo|autor=Mettiger KL, Ericson K|tytuł=Fibromuscular dysplasia and the brain II: current concept of disease|czasopismo=Stroke|rok=1982|oznaczenie=13|strony=53-58| |
Dysplazja włóknisto-mięśniowa tętnic szyjnych, dotycząca przede wszystkim [[tętnica szyjna wewnętrzna|tętnicy szyjnej wewnętrznej]], rzadko jest objawowa<ref name=plouin/>. Może być wykryta przypadkowo podczas badania dopplerowskiego naczyń szyjnych u pacjentów z zawrotami głowy, bólami głowy lub bezobjawowym szmerem naczyniowym nad szyją<ref name=mettiger>{{Cytuj pismo|autor=Mettiger KL, Ericson K|tytuł=Fibromuscular dysplasia and the brain II: current concept of disease|czasopismo=Stroke|rok=1982|oznaczenie=13|strony=53-58|pmid=7039003}}</ref>. Objawy neurologiczne stwierdza się, gdy FMD tętnic szyjnych jest powikłana przez niedokrwienie mózgu, zator lub zakrzepicę, spowodowane rozwarstwieniem ściany tętnicy lub współwystępowaniem objawowych tętniaków. Powikłania mogą obejmować [[zespół Hornera]], [[przemijający atak niedokrwienny]], lub [[krwotok podpajęczynówkowy]]. Krwotok spowodowany pęknięciem tętniaka towarzyszący udarowi niedokrwiennemu spowodowanemu stenozą są charakterystyczne dla FMD naczyń mózgowych<ref name=ericson>{{Cytuj pismo|autor= Mettiger KL, Ericson K|tytuł=Fibromuscular dysplasia and the brain – Observations on angiographic, clinical and genetic characteristics|czasopismo=Stroke|rok=1982|oznaczenie=13|strony=46-52}}</ref>. |
||
; FMD innych lokalizacji: |
; FMD innych lokalizacji: |
||
Dysplazję włóknisto-mięśniową stwierdzano także w [[pień trzewny|pniu trzewnym]], [[tętnica krezkowa górna|górnej]] i [[tętnica krezkowa dolna|dolnej tętnicy krezkowej]], [[tętnica wątrobowa|tętnicy wątrobowej]], [[tętnica śledzionowa|śledzionowej]] i w [[Krążenie wieńcowe|tętnicach wieńcowych]]<ref name=luscher/>. Większość pacjentów z FMD naczyń trzewnych jest bezobjawowa, ale choroba rzadko może się manifestować niedokrwieniem krezki (poposiłkowy ból brzucha, utrata wagi, szmer w nadbrzuszu) i rzadziej, zawałem krezki i niewydolnością wielonarządową<ref name=guill>{{Cytuj pismo|autor=Guill CK, Benavides DC, Rees C, Fenves AZ, Burton EC|tytuł=Fatal mesenteric fibromuscular dysplasia: a case report and review of the literature|czasopismo=Arch Intern Med|rok=2004|oznaczenie=164|strony=1148-1153| |
Dysplazję włóknisto-mięśniową stwierdzano także w [[pień trzewny|pniu trzewnym]], [[tętnica krezkowa górna|górnej]] i [[tętnica krezkowa dolna|dolnej tętnicy krezkowej]], [[tętnica wątrobowa|tętnicy wątrobowej]], [[tętnica śledzionowa|śledzionowej]] i w [[Krążenie wieńcowe|tętnicach wieńcowych]]<ref name=luscher/>. Większość pacjentów z FMD naczyń trzewnych jest bezobjawowa, ale choroba rzadko może się manifestować niedokrwieniem krezki (poposiłkowy ból brzucha, utrata wagi, szmer w nadbrzuszu) i rzadziej, zawałem krezki i niewydolnością wielonarządową<ref name=guill>{{Cytuj pismo|autor=Guill CK, Benavides DC, Rees C, Fenves AZ, Burton EC|tytuł=Fatal mesenteric fibromuscular dysplasia: a case report and review of the literature|czasopismo=Arch Intern Med|rok=2004|oznaczenie=164|strony=1148-1153|pmid=15159274}}</ref>. Pacjenci z FMD tętnic kończyn dolnych mogą mieć uczucie zimnych nóg, [[chromanie przestankowe]] lub objawy zatoru w dystalnych częściach kończyn. Chorzy z FMD [[tętnica podobojczykowa|tętnicy podobojczykowej]] prezentują osłabienie ręki, [[Parestezja|parestezje]], chromanie i objawy [[zespół podkradania|zespołu podkradania]]<ref name=luscher/><ref name=mettiger/>. |
||
== Diagnostyka == |
== Diagnostyka == |
||
| Linia 95: | Linia 95: | ||
== Różnicowanie == |
== Różnicowanie == |
||
Diagnostyka różnicowa FMD obejmuje zwężenia na tle [[Miażdżyca|miażdżycowym]], [[zespół Ehlersa-Danlosa|zespołu Ehlersa i Danlosa]], [[zespół Williamsa|zespołu Williamsa]] i [[nerwiakowłókniakowatość|nerwiakowłókniakowatości typu 1]]<ref name=plouin/>. FMD jest z definicji niezapalna, ale trudność może sprawiać niekiedy zróżnicowanie jej z zapalnymi chorobami naczyń<ref name=nejm>{{Cytuj pismo|autor=Slovut, DP, Olin, JW|tytuł=Fibromuscular dysplasia|czasopismo=[[New England Journal of Medicine]]|oznaczenie=350|wolumin=18|strony=1862-1871|rok=2004| |
Diagnostyka różnicowa FMD obejmuje zwężenia na tle [[Miażdżyca|miażdżycowym]], [[zespół Ehlersa-Danlosa|zespołu Ehlersa i Danlosa]], [[zespół Williamsa|zespołu Williamsa]] i [[nerwiakowłókniakowatość|nerwiakowłókniakowatości typu 1]]<ref name=plouin/>. FMD jest z definicji niezapalna, ale trudność może sprawiać niekiedy zróżnicowanie jej z zapalnymi chorobami naczyń<ref name=nejm>{{Cytuj pismo|autor=Slovut, DP, Olin, JW|tytuł=Fibromuscular dysplasia|czasopismo=[[New England Journal of Medicine]]|oznaczenie=350|wolumin=18|strony=1862-1871|rok=2004|pmid=15115832}}</ref>. [[Olbrzymiokomórkowe zapalenie naczyń]] może przebiegać bez zmian w reaktantach ostrej fazy u do 40% pacjentów<ref name=jaff>{{Cytuj pismo|autor=Jaff MR, Olin JW, Young JR|tytuł=Failure of acute phase reactants to predict disease activity in Takayasu’s arteritis|czasopismo=J Vasc Med Biol|rok=1993|oznaczenie=4|strony=223-7}}</ref>. Obraz angiograficzny tych dwóch chorób jest podobny i gdy histiologicznie nie można stwierdzić oznak procesu zapalnego, różnicowanie jest trudne szczególnie w przypadku zajęcia błony wewnętrznej większej liczby naczyń. W niektórych przypadkach pomocne jest wewnątrznaczyniowe USG<ref name=gowda>{{Cytuj pismo|autor=Gowda MS, Loeb AL, Crouse LJ, Kramer PH|tytuł=Complementary roles of color-flow duplex imaging and intravascular ultrasound in the diagnosis of renal artery fibromuscular dysplasia: should renal arteriography serve as the „gold standard”? |czasopismo=J Am Coll Cardiol|rok=2003|oznaczenie=41|strony=1305-1311|url=http://content.onlinejacc.org/cgi/content/abstract/41/8/1305?ijkey=76e765f59d56f31d9244d847df2fc017e93000ae&keytype2=tf_ipsecsha|pmid=12706925}}</ref>. |
||
== Leczenie == |
== Leczenie == |
||
| Linia 101: | Linia 101: | ||
W leczeniu postaci nerkowej stosuje się [[leki hipotensyjne]], przezskórną [[angioplastyka|angioplastykę]] ciężkich zwężeń i chirurgiczną rekonstrukcję naczynia w przypadkach z zajęciem tętnic segmentalnych. Wskazania do angioplastyki balonowej w FMD są szersze niż w miażdżycowej chorobie naczyń nerkowych, ponieważ ciśnienie tętnicze krwi lepiej się stabilizuje w tej grupie pacjentów<ref>{{Cytuj pismo|autor=Ramsay LE, Waller PC|tytuł=Blood pressure response to percutaneous transluminal angioplasty for renovascular hypertension: an overview of published series|czasopismo=Br Med J|rok=1990|oznaczenie=300|strony=569-572}}</ref>. Progresja zwężenia naczyń nerkowych jest powolna i FMD rzadko prowadzi do niedokrwienia miąższu nerki. |
W leczeniu postaci nerkowej stosuje się [[leki hipotensyjne]], przezskórną [[angioplastyka|angioplastykę]] ciężkich zwężeń i chirurgiczną rekonstrukcję naczynia w przypadkach z zajęciem tętnic segmentalnych. Wskazania do angioplastyki balonowej w FMD są szersze niż w miażdżycowej chorobie naczyń nerkowych, ponieważ ciśnienie tętnicze krwi lepiej się stabilizuje w tej grupie pacjentów<ref>{{Cytuj pismo|autor=Ramsay LE, Waller PC|tytuł=Blood pressure response to percutaneous transluminal angioplasty for renovascular hypertension: an overview of published series|czasopismo=Br Med J|rok=1990|oznaczenie=300|strony=569-572}}</ref>. Progresja zwężenia naczyń nerkowych jest powolna i FMD rzadko prowadzi do niedokrwienia miąższu nerki. |
||
; Postać szyjna: |
; Postać szyjna: |
||
Możliwości terapeutyczne zabezpieczenia pękniętych tętniaków naczyń mózgowych obejmują neurochirurgiczne zabezpieczenie naczyń klipsami lub wprowadzeniem do światła naczynia tzw. koili (ang. ''endovascular coiling'')<ref name=suarez>{{Cytuj pismo|autor=Suarez JI, Tarr RW, Selman WR|tytuł=Aneurysmal subarachnoid hemorrhage|czasopismo=[[New England Journal of Medicine]]|rok=2006|oznaczenie=354|strony=387-396| |
Możliwości terapeutyczne zabezpieczenia pękniętych tętniaków naczyń mózgowych obejmują neurochirurgiczne zabezpieczenie naczyń klipsami lub wprowadzeniem do światła naczynia tzw. koili (ang. ''endovascular coiling'')<ref name=suarez>{{Cytuj pismo|autor=Suarez JI, Tarr RW, Selman WR|tytuł=Aneurysmal subarachnoid hemorrhage|czasopismo=[[New England Journal of Medicine]]|rok=2006|oznaczenie=354|strony=387-396|pmid=16436770}}</ref>. |
||
{{Przypisy|2}} |
{{Przypisy|2}} |
||
== Bibliografia == |
== Bibliografia == |
||
* {{Cytuj pismo|autor=Pierre-François Plouin, Jérôme Perdu, Agnès La Batide-Alanore, Pierre Boutouyrie, Anne-Paule Gimenez-Roqueplo, Xavier Jeunemaitre|tytuł=Fibromuscular dysplasia|czasopismo=Orphanet Journal of Rare Diseases|url=http://www.ojrd.com/content/2/1/28|rok=2007|oznaczenie=2|wolumin=28| |
* {{Cytuj pismo|autor=Pierre-François Plouin, Jérôme Perdu, Agnès La Batide-Alanore, Pierre Boutouyrie, Anne-Paule Gimenez-Roqueplo, Xavier Jeunemaitre|tytuł=Fibromuscular dysplasia|czasopismo=Orphanet Journal of Rare Diseases|url=http://www.ojrd.com/content/2/1/28|rok=2007|oznaczenie=2|wolumin=28|pmid=17555581}} |
||
* {{Cytuj pismo|autor=David P. Slovut, Jeffrey W. Olin|tytuł=Fibromuscular dysplasia|czasopismo=[[New England Journal of Medicine]]|rok=2004|oznaczenie=350|wolumin=18|strony=1862-1871| |
* {{Cytuj pismo|autor=David P. Slovut, Jeffrey W. Olin|tytuł=Fibromuscular dysplasia|czasopismo=[[New England Journal of Medicine]]|rok=2004|oznaczenie=350|wolumin=18|strony=1862-1871|pmid=15115832}} |
||
== Linki zewnętrzne == |
== Linki zewnętrzne == |
||
Wersja z 17:05, 18 gru 2016
| {{{nazwa naukowa}}} | |
| Synonimy |
{{{synonimy}}} |
|---|---|
| Specjalizacja |
{{{specjalizacja}}} |
| Objawy |
{{{objawy}}} |
| Powikłania |
{{{powikłania}}} |
| Początek |
{{{początek}}} |
| Czas trwania |
{{{czas trwania}}} |
| Typy |
{{{typy}}} |
| Przyczyny |
{{{przyczyny}}} |
| Czynniki ryzyka |
{{{czynniki ryzyka}}} |
| Rozpoznanie |
{{{rozpoznanie}}} |
| Różnicowanie |
{{{różnicowanie}}} |
| Zapobieganie |
{{{zapobieganie}}} |
| Leczenie |
{{{leczenie}}} |
| Leki |
{{{leki}}} |
| Rokowanie |
{{{rokowanie}}} |
| Zapadalność |
{{{zapadalność}}} |
| Śmiertelność |
{{{śmiertelność}}} |
| Klasyfikacje | |
| ICD-11 |
{{{ICD11}}} |
| ICD-10 | |
| DSM-5 |
{{{DSM-5}}} |
| DSM-IV |
{{{DSM-IV}}} |
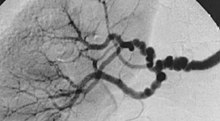
Dysplazja włóknisto-mięśniowa (ang. fibromuscular dysplasia, FMD, fibromuscular fibroplasia) – grupa niemiażdżycowych, niezapalnych chorób naczyń tętniczych, przede wszystkim tętnic nerkowych i szyjnych. Częstość objawowej dysplazji włóknisto-mięśniowej naczyń nerkowych szacuje się na 4:1000, a częstość naczyń szyjnych i mózgowych jest przypuszczalnie o połowę mniejsza.
Najczęstszym objawem dysplazji włóknisto-mięśniowej naczyń nerkowych jest nadciśnienie tętnicze nerkopochodne. Wieloogniskowe zwężenia i „obraz sznura pereł” stwierdza się w ponad 80% przypadków, przede wszystkim u kobiet między 40. a 50. rokiem życia. Schorzenie to zajmuje najczęściej 2/3 długości tętnicy nerkowej (odcinek dystalny i środkowy), a w niektórych przypadkach także gałęzie tętnicy nerkowej. Szyjno-czaszkowa dysplazja włóknisto-mięśniowa może wiązać się z takimi powikłaniami, jak rozwarstwienie tętnicy, migreny, zespół Hornera, udar i może przebiegać z tworzeniem tętniaków tętnic mózgowych, stwarzających ryzyko krwawienia podpajęczynówkowego lub śródmózgowego. Etiologia dysplazji włóknisto-mięśniowej nie jest znana, sugerowano wpływ czynników mechanicznych i hormonalnych. W około 10% przypadków występuje rodzinnie, więc postuluje się również udział czynników genetycznych w jej patogenezie.
Historia
Dysplazję włóknisto-mięśniową tętnic opisali pierwsi Leadbetter i Burkland w 1938 roku u 5-letniego chłopca jako chorobę tętnic nerkowych[2]. Zajęcie naczyń tętniczych czaszkowo-szyjnych opisali w 1946 roku Palubinskas i Ripley[3]. W 1958 roku McCormack i wsp. przedstawili obserwacje histopatologiczne nad zmienionymi tętnicami nerkowymi u czterech pacjentów z nadciśnieniem nerkopochodnym i stwierdzili hiperplazję komórek naczynia[4]. W 1965 roku Hunt i wsp. stwierdzili heterogeniczność choroby i wprowadzili termin dysplazji włóknisto-mięśniowej w miejsce używanej wcześniej nazwy hiperplazji włóknisto-mięśniowej[5].
Epidemiologia
Wczesne wyniki badań autopsyjnych i radiologicznych sugerowały, że częstość FMD naczyń szyjno-czaszkowych wynosi około 1% populacji, ale nowsze badania szacują ją na 0,02%.[6] Uważa się, że 10-20% zwężeń tętnic nerkowych jest konsekwencją FMD; ponieważ nadciśnienie nerkopochodne odpowiada za mniej niż 1-2% przypadków nadciśnienia, można przypuszczać, że istotna klinicznie FMD tętnic nerkowych występuje z częstością 0,4% populacji. Bezobjawowa dysplazja włóknisto-mięśniowa jest przypuszczalnie rząd wielkości częstsza; w czterech dużych badaniach angiograficznych[7][8][9][10] łącznie 3181 potencjalnych dawców nerek FMD zdiagnozowano u 139 z nich, co daje częstość 4,4%[1].
Klasyfikacja

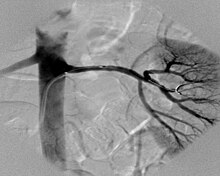
Klasyfikacja histologiczna schorzenia (zaproponowana przez McCormack i wsp.[12][13] poprawiona przez Stanleya[14]) wyróżnia trzy główne typy:
- z zajęciem błony wewnętrznej (ang. intimal type)
- środkowej (ang. medial type)
- na zewnątrz od niej (ang. perimedial type)
Wszystkie trzy typy mogą występować samodzielnie albo łącznie u jednego pacjenta. Klasyfikacja angiograficzna wyróżnia typ wieloogniskowy (multifocal type), z licznymi zwężeniami i obrazem „sznura pereł”, któremu w klasyfikacji histologicznej odpowiada typ z zajęciem błony wewnętrznej, typ cewkowy i typ ogniskowy, nie pokrywające się z klasyfikacją histologiczną.
| Klasyfikacja angiograficzna FMD | |||
|---|---|---|---|
| Typ I | Typ wieloogniskowy (multifocal type) | 62%[15] | 
|
| Typ II | Typ cewkowy (tubular type) | 14%[15] | 
|
| Typ III | Typ ogniskowy (focal type) | 7%[15] | 
|
Etiologia

Przypuszczalnie w etiologii FMD mają udział czynniki genetyczne. Donoszono o możliwym związku FMD z mutacjami w genie kolagenu[16] ze skórą wiotką (cutis laxa)[17] i niedoborem α1-antytrypsyny[18]. Donoszono o pojedynczych przypadkach występowania FMD u pacjentów z zespołem Marfana[19] nerwiakowłókniakowatością, zespołem Alporta[20] zapaleniem naczyń Takayasu[21][22] i guzem chromochłonnym[23][24][25].
Udział czynników środowiskowych nie jest jasny; w kilku badaniach stwierdzono, że pacjenci z FMD częściej palą papierosy[26][27][28], a u tych, którzy palą, przebieg choroby jest cięższy[29]. Nie określono jednak mechanizmów jakie miałyby wywoływać FMD u palaczy[1]. Częstsze występowanie FMD u kobiet sugeruje udział ekspozycji na endogenne albo egzogenne estrogeny w predyspozycji do FMD, ale liczba ciąży i częstość stosowania antykoncepcji hormonalnej w grupie pacjentek z FMD nie różni się znacząco od grupy kontrolnej[26][28].
Objawy i przebieg
| Obrazy FMD w USG[30] | |
|---|---|
| Objaw „sznura pereł” w kolorowym doplerze u 51-letniej kobiety z zawężającą FMD wewnętrznej tętnicy szyjnej niskiego stopnia. | |
| USG-Power Doppler lewej tętnicy szyjnej wewnętrznej u 53-letniej kobiety cierpiącej na migrenę- obraz „sznura pereł” typowy dla FMD. | 
|
| Ten sam przypadek; dopler spektralny pozwala ocenić zwężenie lewej tętnicy szyjnej na około 70%. | 
|
| Obraz prawej tętnicy szyjnej wewnętrznej tej samej pacjentki. | 
|
| Zwężenie dużego stopnia tętnicy szyjnej wewnętrznej u 52-letniej kobiety cierpiącej na nawracające TIA. | 
|
- FMD tętnic nerkowych
Najczęstszą manifestacją FMD jest nadciśnienie tętnicze nerkopochodne wtórne do zwężenia tętnicy nerkowej[1]. Stenoza naczynia spowodowana dysplazją włóknisto-mięśniową może skutkować nadciśnieniem każdego stopnia, ale najczęściej jest wykrywana u pacjentów z II i III stopniem choroby nadciśnieniowej, z nadciśnieniem o nagłym początku lub nadciśnieniem złośliwym. W górnym kwadrancie brzucha lub w boku pacjenta można stwierdzić osłuchiwaniem szmer naczyniowy[31], ale czułość i specyficzność tego objawu są ograniczone[32]. Powikłania nerkowej dysplazji włóknisto-mięśniowej obejmują rozwarstwienie tętnicy nerkowej objawiające się gwałtownym bólem w boku, krwiomoczem i gwałtownie rosnącym nadciśnieniem[33]. Jako skutek aktywacji układu renina-angiotensyna-aldosteron u pacjenta może rozwinąć się hipokaliemia odzwierciedlająca wtórny hiperaldosteronizm, szczególnie w przypadkach powikłanych rozwarstwieniem tętnicy nerkowej i zawałem nerki[33][34]. W przeciwieństwie do miażdżycowych zwężeń tętnicy nerkowej, nerkowa FMD rzadko wiąże się z podwyższonymi poziomami kreatyniny w osoczu.
- FMD naczyń szyjnych
Dysplazja włóknisto-mięśniowa tętnic szyjnych, dotycząca przede wszystkim tętnicy szyjnej wewnętrznej, rzadko jest objawowa[1]. Może być wykryta przypadkowo podczas badania dopplerowskiego naczyń szyjnych u pacjentów z zawrotami głowy, bólami głowy lub bezobjawowym szmerem naczyniowym nad szyją[35]. Objawy neurologiczne stwierdza się, gdy FMD tętnic szyjnych jest powikłana przez niedokrwienie mózgu, zator lub zakrzepicę, spowodowane rozwarstwieniem ściany tętnicy lub współwystępowaniem objawowych tętniaków. Powikłania mogą obejmować zespół Hornera, przemijający atak niedokrwienny, lub krwotok podpajęczynówkowy. Krwotok spowodowany pęknięciem tętniaka towarzyszący udarowi niedokrwiennemu spowodowanemu stenozą są charakterystyczne dla FMD naczyń mózgowych[36].
- FMD innych lokalizacji
Dysplazję włóknisto-mięśniową stwierdzano także w pniu trzewnym, górnej i dolnej tętnicy krezkowej, tętnicy wątrobowej, śledzionowej i w tętnicach wieńcowych[26]. Większość pacjentów z FMD naczyń trzewnych jest bezobjawowa, ale choroba rzadko może się manifestować niedokrwieniem krezki (poposiłkowy ból brzucha, utrata wagi, szmer w nadbrzuszu) i rzadziej, zawałem krezki i niewydolnością wielonarządową[37]. Pacjenci z FMD tętnic kończyn dolnych mogą mieć uczucie zimnych nóg, chromanie przestankowe lub objawy zatoru w dystalnych częściach kończyn. Chorzy z FMD tętnicy podobojczykowej prezentują osłabienie ręki, parestezje, chromanie i objawy zespołu podkradania[26][35].
Diagnostyka
Nieinwazyjne metody obrazowania choroby obejmują (od najmniej do najbardziej dokładnych) USG, angiografię rezonansu magnetycznego (MRIA) i angiografię tomografii komputerowej (CTA). Złotym standardem diagnostyki FMD jest angiografia, ale ta inwazyjna metoda stosowana jest wyłącznie jeśli jednoczasowo można przeprowadzić udrożnienie naczyń tętniczych.
Różnicowanie
Diagnostyka różnicowa FMD obejmuje zwężenia na tle miażdżycowym, zespołu Ehlersa i Danlosa, zespołu Williamsa i nerwiakowłókniakowatości typu 1[1]. FMD jest z definicji niezapalna, ale trudność może sprawiać niekiedy zróżnicowanie jej z zapalnymi chorobami naczyń[38]. Olbrzymiokomórkowe zapalenie naczyń może przebiegać bez zmian w reaktantach ostrej fazy u do 40% pacjentów[39]. Obraz angiograficzny tych dwóch chorób jest podobny i gdy histiologicznie nie można stwierdzić oznak procesu zapalnego, różnicowanie jest trudne szczególnie w przypadku zajęcia błony wewnętrznej większej liczby naczyń. W niektórych przypadkach pomocne jest wewnątrznaczyniowe USG[40].
Leczenie
- Postać nerkowa
W leczeniu postaci nerkowej stosuje się leki hipotensyjne, przezskórną angioplastykę ciężkich zwężeń i chirurgiczną rekonstrukcję naczynia w przypadkach z zajęciem tętnic segmentalnych. Wskazania do angioplastyki balonowej w FMD są szersze niż w miażdżycowej chorobie naczyń nerkowych, ponieważ ciśnienie tętnicze krwi lepiej się stabilizuje w tej grupie pacjentów[41]. Progresja zwężenia naczyń nerkowych jest powolna i FMD rzadko prowadzi do niedokrwienia miąższu nerki.
- Postać szyjna
Możliwości terapeutyczne zabezpieczenia pękniętych tętniaków naczyń mózgowych obejmują neurochirurgiczne zabezpieczenie naczyń klipsami lub wprowadzeniem do światła naczynia tzw. koili (ang. endovascular coiling)[42].
- ↑ a b c d e f g Plouin PF, Perdu J, La Batide-Alanore A, Boutouyrie P, Gimenez-Roqueplo AP, Jeunemaitre X. Fibromuscular dysplasia. „Orphanet Journal of Rare Diseases”. 2. 28, 2007. PMID: 17555581.
- ↑ Leadbetter WF, Burkland CD. Hypertension in unilateral renal disease. „J Urol”. 39, s. 611-26, 1938.
- ↑ Palubinskas AJ, Ripley HR. Fibromuscular hyperplasia in extrarenal arteries. „Radiology”. 82, s. 451-55, 1946.
- ↑ McCormack LJ, Hazard JB, Poutasse EF. Obstructive lesions of renal artery associated with remediable hypertension. „Am J Pathol”. 34, s. 582, 1958.
- ↑ Hunt J, Harrison EG, Sheps SG, Bernatz PE, Davis GD. Hypertension caused by fibromuscular dyplasia of renal arteries. „Postgrad Med”. 38, s. 53-63, 1965. PMID: 14314048.
- ↑ Schievink WI, Bjornsson J. Fibromuscular dysplasia of the internal carotid artery: a clinicopathological study. „Clin Neuropathol”. 15. 1, s. 2-6, 1996.
- ↑ Spring DB, Salvatierra O Jr, Palubinskas AJ, Amend WJ Jr, Vincenti FG, Feduska NJ. Results and significance of angiography in potential kidney donors. „Radiology”. 133, s. 45-47, 1979.
- ↑ Cragg AH, Smith TP, Thompson BH, Maroney TP, Stanson AW, Shaw GT, Hunter DW, Cochran ST. Incidental fibromuscular dysplasia in potential renal donors: long-term clinical follow-up. „Radiology”. 172, s. 145-147, 1989. P.
- ↑ Neymark E, LaBerge JM, Hirose R, Melzer JS, Kerlan RK Jr, Wilson MW, Gordon RL. Arteriographic detection of renovascular disease in potential renal donors: incidence and effect on donor surgery. „Radiology”. 214, s. 755-760, 2000. PMID: 10715042.
- ↑ Andreoni KA, Weeks SM, Gerber DA, Fair JH, Mauro MA, McCoy L, Scott L, Johnson MW. Incidence of donor renal fibromuscular dysplasia: does it justify routine angiography?. „Transplantation”. 73, s. 1112-1116, 2002. PMID: 11965042.
- ↑ a b Zeina AR, Vladimir W, Barmeir E. Fibromuscular dysplasia in an accessory renal artery causing renovascular hypertension: a case report. „Journal of Medical Case Reports”. 1. 58, 2007. PMID: 17672905.
- ↑ McCormack LJ, Poutasse EF, Meaney TF, Noto TJ Jr, Dustan HP. A pathologic-arteriographic correlation of renal arterial disease. „Am Heart J”. 72, s. 188-198, 1966. PMID: 5915557.
- ↑ Harrison EG Jr, McCormack LJ. Pathologic classification of renal arterial disease in renovascular hypertension. „Mayo Clin Proc”. 46, s. 161-167, 1971. PMID: 5553126.
- ↑ Renal artery fibrodysplasia. W: Stanley JC: Renal Vascular Disease. Novick AC, Scable J, Hamilton G (ed.). London: WB Saunders, 1996, s. 21-23.
- ↑ a b c Kincaid OW, Davis GD, Hallermann FJ, Hunt JC. Fibromuscular dysplasia of the renal arteries: arteriographic features, classification, and observation on natural history of the disease. „Am J Roentgenol”. 104, s. 271-282, 1968.
- ↑ Tromp G, Wu Y, Prockop DJ, Madhatheri SL, Kleinert C, Earley JJ, Zhuang J, Norrgård O, Darling RC, Abbott WM, et al. Sequencing of cDNA from 50 unrelated patients reveals that mutations in the triple-helical domain of type III procollagen are an infrequent causeof aortic aneurysms. „J Clin Invest”. 91. 6, s. 2539-45, 1993. PMID: 8514866.
- ↑ McKusick VA: Heritable Disorders of Connective Tissue. St Louis: Mosby-Yearbook, 1972, s. 382-6.
- ↑ Schievink WI, Meyer FB, Parisi JE, Wijdicks EF. Fibromuscular dysplasia of the internal carotid artery associated with alpha1-antitrypsin deficiency. „Neurosurgery”. 43. 2, s. 229-33, 1998. PMID: 9696074.
- ↑ Schievink WI, Bjornsson J, Piepgras DG. Coexistence of fibromuscular dysplasia and cystic medial necrosis in a patient with Marfan’s syndrome and bilateral carotid artery dissections. „Stroke”. 25, s. 2492-2496, 1994.
- ↑ Hudgins LB, Limbacher JP. Fibromuscular dysplasia in Alport’s syndrome. „J Tenn Med Assoc”. 75, s. 733-735, 1982. PMID: 7176628.
- ↑ Janzen J, Vuong PN, Rothenberger-Janzen K. Takayasu’s arteritis and fibromuscular dysplasia as causes of acquired atypical coarctation of the aorta: retrospective analysis of seven cases. „Heart Vessels”. 14, s. 277-282, 1999. PMID: 10901482.
- ↑ D’Souza SJ, Tsai WS, Silver MM, et al. Diagnosis and management of stenotic aorto-arteriopathy in childhood. „J Pediatr”. 132, s. 1016-1022, 1998. PMID: 9627596.
- ↑ Miscellaneous arterial diseases. W: Gray GH, Young JR, Olin JW: Peripheral Vascular Diseases. Young JR, Olin JW, Bartholomew J (red.). St Louis: Mosby-Yearbook, 1996, s. 425-40.
- ↑ Qunibi WJ, Taylor TK, Knight TF, Senekjian HO, Gomez L, Weinman EJ. Pheochromocytoma and fibromuscular hyperplasia. „South Med J”. 72, s. 1481-1482, 1979. PMID: 505091.
- ↑ de Mendonca WC, Espat PA. Pheochromocytoma associated with arterial fibromuscular dysplasia. „Am J Clin Pathol”. 75, s. 749-754, 1981. PMID: 7234761.
- ↑ a b c d Luscher TF, Lie JT, Stanson AW, Houser OW, Hollier LH, Sheps SG. Arterial fibromuscular dysplasia. „Mayo Clin Proc”. 62, s. 931-952, 1987. PMID: 3309488.
- ↑ Nicholson JP, Teichman SL, Alderman MH, Sos TA, Pickering TG, Laragh JH. Cigarette smoking and renovascular hypertension. „Lancet”. 2, s. 765-766, 1983. PMID: 6137603.
- ↑ a b Sang CN, Whelton PK, Hamper UM, Connolly M, Kadir S, White RI, Sanders R, Liang KY, Bias W. Etiologic factors in renovascular fibromuscular dysplasia. A case-control study. „Hypertension”. 14, s. 472-479, 1989. PMID: 2680961.
- ↑ Bofinger A, Hawley C, Fisher P, Daunt N, Stowasser M, Gordon R. Increased severity of multifocal renal arterial fibromuscular dysplasia in smokers. „J Hum Hypertens”. 13, s. 517-520, 1999. PMID: 10455472.
- ↑ Arning C, Grzyska U. Color Doppler imaging of cervicocephalic fibromuscular dysplasia. „Cardiovascular Ultrasound”. 2. 7, 2004. PMID: 15265239.
- ↑ Pannier-Moreau I, Grimbert P, Fiquet-Kempf B, Vuagnat A, Jeunemaitre X, Corvol P, Plouin PF. Possible familial origin of multifocal renal artery fibromuscular dysplasia. „J Hypertens”. 15, s. 1797-801, 1997.
- ↑ Turnbull JM. Is listening for abdominal bruits useful in the evaluation of hypertension?. „JAMA”. 274, s. 1299-1301, 1995. PMID: 7563536.
- ↑ a b Paris B, Bobrie G, Rossignol P, Le Coz S, Chedid A, Plouin PF. Blood pressure and renal outcomes in patients with kidney infarction and hypertension. „J Hypertens”. 24. 8, s. 1649-1654, 2006. PMID: 16877969.
- ↑ Renin-angiotensin II-related hypertension. W: Plouin PF, Corvol P: Endocrinology. Pinchera A (ed.). McGraw-Hill Clinical Medicine Series, 2001, s. 355-60.
- ↑ a b Mettiger KL, Ericson K. Fibromuscular dysplasia and the brain II: current concept of disease. „Stroke”. 13, s. 53-58, 1982. PMID: 7039003.
- ↑ Mettiger KL, Ericson K. Fibromuscular dysplasia and the brain – Observations on angiographic, clinical and genetic characteristics. „Stroke”. 13, s. 46-52, 1982.
- ↑ Guill CK, Benavides DC, Rees C, Fenves AZ, Burton EC. Fatal mesenteric fibromuscular dysplasia: a case report and review of the literature. „Arch Intern Med”. 164, s. 1148-1153, 2004. PMID: 15159274.
- ↑ Slovut, DP, Olin, JW. Fibromuscular dysplasia. „New England Journal of Medicine”. 350. 18, s. 1862-1871, 2004. PMID: 15115832.
- ↑ Jaff MR, Olin JW, Young JR. Failure of acute phase reactants to predict disease activity in Takayasu’s arteritis. „J Vasc Med Biol”. 4, s. 223-7, 1993.
- ↑ Gowda MS, Loeb AL, Crouse LJ, Kramer PH. Complementary roles of color-flow duplex imaging and intravascular ultrasound in the diagnosis of renal artery fibromuscular dysplasia: should renal arteriography serve as the „gold standard”?. „J Am Coll Cardiol”. 41, s. 1305-1311, 2003. PMID: 12706925.
- ↑ Ramsay LE, Waller PC. Blood pressure response to percutaneous transluminal angioplasty for renovascular hypertension: an overview of published series. „Br Med J”. 300, s. 569-572, 1990.
- ↑ Suarez JI, Tarr RW, Selman WR. Aneurysmal subarachnoid hemorrhage. „New England Journal of Medicine”. 354, s. 387-396, 2006. PMID: 16436770.
Bibliografia
- Pierre-François Plouin, Jérôme Perdu, Agnès La Batide-Alanore, Pierre Boutouyrie, Anne-Paule Gimenez-Roqueplo, Xavier Jeunemaitre. Fibromuscular dysplasia. „Orphanet Journal of Rare Diseases”. 2. 28, 2007. PMID: 17555581.
- David P. Slovut, Jeffrey W. Olin. Fibromuscular dysplasia. „New England Journal of Medicine”. 350. 18, s. 1862-1871, 2004. PMID: 15115832.
Linki zewnętrzne
- James Wilson: Fibromuscular dysplasia. eMedicine Neurology, 2005. [dostęp 21 sierpnia 2007].
- The Fibromuscular Dysplasia Society of America.
- FIBROMUSCULAR DYSPLASIA OF ARTERIES w bazie Online Mendelian Inheritance in Man (ang.)

