Choroba Behçeta
| morbus Behçeti | |
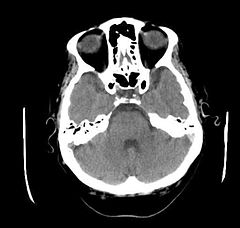 CT głowy pacjenta z objawami neurologicznymi w przebiegu choroby Behçeta, hiperdensyjna lewa zatoka esowata | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|


Choroba Behçeta (choroba Adamantiadesa-Behçeta, łac. morbus Behçeti, ang. Behçet's disease) – układowe zapalenie naczyń małych, średnich i dużych, które współistnieje z bolesnymi owrzodzeniami skóry oraz błon śluzowych narządów płciowych i jamy ustnej, a także z zajęciem procesem chorobowym różnych narządów (stawy, oczy, układ nerwowy, przewód pokarmowy).
Historia[edytuj | edytuj kod]
Choroba po raz pierwszy została prawdopodobnie opisana już w V wieku p.n.e. przez Hipokratesa[1]. Autorem pierwszego opisu schorzenia w czasach nowożytnych był w roku 1931 grecki okulista Benediktos Adamantiades[2]. Choroba przyjęła natomiast nazwę od nazwiska Hulusi Behçeta (czyt. /behˈtʃeta/; 1889–1948), tureckiego dermatologa, który w roku 1924 stwierdził objawy tego schorzenia u jednego ze swoich pacjentów i opisał je jako symptomy nowej jednostki chorobowej w 1936 roku w Archives of Skin and Veneral Diseases[3]. Nazwa choroby została oficjalnie przyjęta na Międzynarodowym Kongresie Dermatologicznym w Genewie w roku 1947.
Epidemiologia[edytuj | edytuj kod]
Choroba występuje najczęściej w Turcji (80–370 przypadków/100 tys. mieszkańców/rok)[4] i krajach Bliskiego Wschodu. W Europie i USA jest to schorzenie zdecydowanie rzadsze, stwierdza się 0,1-7,5 nowych przypadków na 100 tys. obywateli w ciągu roku[4]. Chorują najczęściej ludzie w 3. dekadzie życia a zapadalność jest podobna u obu płci, poza krajami Bliskiego Wschodu, gdzie choroba dotyczy głównie mężczyzn[5].
Etiologia[edytuj | edytuj kod]
Przyczyna choroby nie jest znana, choć bierze się pod uwagę zaburzenia układu immunologicznego, które prowadzą do zapalenia naczyń[5][6].
Kryteria rozpoznania[edytuj | edytuj kod]
- bolesne afty w jamie ustnej (92-100%)[4], pojawiające się co najmniej 3 razy w ciągu roku
- obecność co najmniej 2 z poniższych cech:
- owrzodzenia narządów płciowych (57-93%)[4]
- zmiany dotyczące oczu (29-100%)[4]: zapalenie błony naczyniowej oka lub zapalenie naczyń siatkówki oka
- zmiany skórne (38-99%)[4] takie jak: rumień guzowaty, zmiany pseudo-trądzikowe, wędrujące zapalenie żył powierzchownych skóry
- patergia, czyli powstanie zmian zapalnych dotyczących skóry po jej niewielkim urazie
- zapalenie stawów bez obecności nadżerek (16-84%)[4]
- zaburzenia ośrodkowego układu nerwowego – bóle głowy, zaburzony nastrój, uszkodzenie różnych struktur mózgu (tzw. postać „neuro-Behçet”)
- zakrzepowe zapalenie żył głębokich
- zaburzenia układu pokarmowego – biegunka
Nowe kryteria rozpoznania choroby Behceta - ChB (ICBD - International Criteria for Behcet's Disease) wprowadzono w roku 2013[7]. Są one zarekomendowane jako obowiązujące w chwili obecnej (2018). W odróżnieniu od kryteriów z roku 1990 (ISG - International Study Group) opisanych powyżej, występowanie aft w jamie ustnej nie jest dłużej kryterium obowiązkowym. Kryterium patergii jest kryterium dodatkowym, opcjonalnym. Oprócz pięciu „starych” kryteriów (jama ustna, genitalia, skóra, oczy, patergia), wprowadzono dwa nowe: kryterium układu nerwowego i kryterium układu krwionośnego. Diagnozowanie choroby odbywa się metodą systemu punktowego. Za chorego na ChB uznaje się osobę uzyskującą 4 punkty lub więcej. 2 punkty przypisane są trzem kryteriom - aftozie jamy ustnej, aftozie genitaliów, oraz problemom związanym z oczami. Jeden punkt przypisany jest zmianom skórnym, zmianom w układzie nerwowym oraz zmianom w układzie krwionośnym. Dodatkowo można otrzymać 1 punkt za pozytywny wynik testu patergii. Uzyskanie sześciu lub więcej punktów klasyfikuje pacjenta jako chorego z prawdopodobieństwem w granicach 99 procent (prawdopodobieństwo że osoba zdrowa zostanie zakwalifikowana jako chora jest mniejsze niż 1%)[8] Jakakolwiek kombinacja dwóch z trzech kryteriów za 2 punkty klasyfikuje pacjenta jako osobę chorą, jest to znaczne obniżenie poziomu rozpoznawalności ChB względem ISG, gdzie pacjent musiał spełniać 3 kryteria (główne - jama ustna, plus dwa z czterech dodatkowych).
ICBD różni od ISG znaczny wzrost czułości testu - z 81% do 94%, przy jednoczesnym niewielkim spadku swoistości z 96% do 92%, co jest nadal wynikiem zadowalającym. Również próba użyta do wnioskowania jest bardziej reprezentatywna - przeprowadzono badania na 2556 pacjentach z ChB oraz 1163 pacjentach kontrolnych z 27 krajów, natomiast ISG obejmowało dane od 914 pacjentów z 7 krajów (jedynie Iran, Turcja, Japonia, Tunezja, Wielka Brytania, USA i Francja). Test patergii uznano za opcjonalny, gdyż jego czułość dla pacjentów z basenu Morza Śródziemnego była bardzo wysoka - w granicach 95%, natomiast u pacjentów z Europy i USA była znacznie niższa. Badania były prowadzone w latach 2005-2006.
| Objaw | Liczba pacjentów Z ChB | Czułość % | Liczba pacjentów naśladowczych | Swoistość % |
|---|---|---|---|---|
| Aftoza jamy ustnej | 1248 | 98 | 378 | 35 |
| Aftoza genitaliów | 950 | 74 | 35 | 94 |
| Manifestacje skórne | 899 | 70 | 76 | 87 |
| Psedofolliculitis | 674 | 53 | 48 | 92 |
| Rumień guzowaty | 406 | 32 | 27 | 95 |
| Aftoza skóry | 56 | 4 | 10 | 98 |
| Zmiany w oku | 703 | 55 | 139 | 76 |
| Zapalenie błony naczyniowej przednie (anterior uveitis) | 508 | 40 | 120 | 79 |
| Zapalenie błony naczyniowej tylne (posterior uveitis) | 482 | 38 | 76 | 87 |
| Zapalenie ukrwienia siatkówki (retinal vasculitis) | 288 | 23 | 21 | 96 |
| Manifestacje stawowe | 652 | 51 | 213 | 63 |
| Arthralgia | 443 | 35 | 161 | 72 |
| Arthritis | 289 | 23 | 76 | 87 |
| Manifestacje neurologiczne | 212 | 17 | 16 | 97 |
| OUN | 155 | 12 | 9 | 98 |
| Obwodowy układ nerwowy | 63 | 5 | 8 | 99 |
| Objawy układu krwionośnego | 242 | 19 | 36 | 94 |
| Objawy układu pokarmowego | 80 | 6 | 17 | 97 |
| Zapalenie najądrza (epididymitis) | 91 | 7 | 9 | 98 |
| Pozytywny test patergii | 419 | 47 | 33 | 92 |
Leczenie[edytuj | edytuj kod]

Obecna terapia polega na łagodzeniu objawów chorobowych, zmniejszeniu stanu zapalnego oraz kontroli układu odpornościowego pacjenta. W leczeniu zmian skórnych wykorzystuje się glikokortykosteroidy, takrolimus, kolchicynę, dapson, antybiotyki, talidomid, interferon-α, metotreksat. W terapii zmian narządowych stosuje się glikokortykosteroidy, intereferon-α, cyklosporynę, azatioprynę, cyklofosfamid. W ostatnich latach wprowadza się do leczenia z dobrym skutkiem nowoczesne leki biologiczne skierowane przeciwko TNF-α: infliksimab zatwierdzony do terapii zapalenia błony naczyniowej oka[9][10] czy etanercept w leczeniu zmian skórnych i śluzówkowych[11].
Rokowanie[edytuj | edytuj kod]
Na ogół dobre, o ile nie dojdzie do zajęcia ośrodkowego układu nerwowego lub płuc.
Przypisy[edytuj | edytuj kod]
- ↑ Johns Hopkins Vasculitis Center ↓.
- ↑ Dimakakos, Tsiligiris i Kotsis 1999 ↓.
- ↑ Saylan 1997 ↓.
- ↑ a b c d e f g Zouboulis 1999 ↓.
- ↑ a b Eguia i in. 2006 ↓.
- ↑ Kontogiannis i Powell 2000 ↓.
- ↑ Journal of the European Academy of Dermatology and Venereology 2014, 28, 338–347, The International Criteria for Behçet's Disease (ICBD): a collaborative study of 27 countries on the sensitivity and specificity of the new criteria. - Semantic Scholar [online] [dostęp 2018-07-23].
- ↑ How is behcets disease diagnosed, „Behcets Syndrome Society, tabela 6” [dostęp 2018-07-23] (ang.).
- ↑ Sfikakis i in. 2001 ↓.
- ↑ Sfikakis 2002 ↓.
- ↑ Melikoglu i in. 2005 ↓.
Bibliografia[edytuj | edytuj kod]
- P.B. Dimakakos, B. Tsiligiris, T. Kotsis, The physician B. Adamantiades and his contribution to the disease Adamantiades-Behçet, „Int Angiol”, 18 (2), International Angiology, 1999, s. 176-81, PMID: 10424377 (ang.).
- A. Eguia, M. Villarroel, R. Martínez-Conde, M.A. Echebarría i inni. Adamantiades-Behçet disease: an enigmatic process with oral manifestations. „Medicina Oral, Patología Oral y Cirugía Bucal”. 11(1), s. E6-11, 1 2006. PMID: 16388284. (ang.).
- Behcets Disease. Johns Hopkins Vasculitis Center. [dostęp 2014-05-10]. (ang.).
- V. Kontogiannis, R.J. Powell. Behçet's disease. „Postgraduate Medical Journal”. 76(900), s. 629-37, 10 2000. PMID: 11009577. (ang.).
- M. Melikoglu i inni, Short-term trial of etanercept in Behcet's disease: a double blind, placebo controlled study, „Journal of Rheumatology”, 32 (1), 2005, s. 98-105, PMID: 15630733 (ang.).
- T. Saylan. Life Story of Dr. Hulusi Behçet. „Yonsei Medical Journal”. 38(6), s. 327-332, 12 1997. PMID: 9509901. (ang.).
- P.P. Sfikakis, P.G. Theodossiadis, C.G. Katsiari, P. Kaklamanis i inni. Effect of infliximab on sight-threatening panuveitis in Behcet's disease. „Lancet”. 358 (9278), s. 295-6, 2001. PMID: 11498218. (ang.).
- P.P. Sfikakis. Behcet's disease: a new target for anti-tumour necrosis factor treatment. „Annals of the Rheumatic Diseases”. 61 supl.2, s. ii51-3, 2002. PMID: 12379622. (ang.).
- Andrzej Szczeklik: Choroby wewnętrzne. T. 2.. Kraków: Medycyna Praktyczna, 2006, s. 1700. ISBN 83-7430-031-0.
- C.C. Zouboulis. Epidemiology of Adamantiades-Behçet's disease. „Annales de Médecine Interne”. 150(6), s. 488-98, 10 1999. PMID: 10615535. (fr.).
Linki zewnętrzne[edytuj | edytuj kod]
- Polskie stowarzyszenie Chorych na Układowe Zapalenia Naczyń "Vasculitis" : Stowarzyszenie Chorych na Układowe Zapalenia Naczyń "Vasculitis" (pol.)
- Zapalenie naczyń w chorobie Behceta [online]. w bazie stowarzyszenia Vasculitis (pol.)
