Heksogen
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny |
C3H6N6O6 | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
C3H6N3(NO2)3 | ||||||||||||||||||||||||
| Masa molowa |
222,12 g/mol | ||||||||||||||||||||||||
| Wygląd |
biały, drobnokrystaliczny proszek[1] | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
Heksogen (cyklonit, T4, Hx, RDX – od ang. royal demolition explosive[3] lub research department explosive) – organiczny związek chemiczny, jedna z nitroamin heterocyklicznych, stosowana jako materiał wybuchowy.
Właściwości[edytuj | edytuj kod]
Prędkość detonacji cyklonitu wynosi 8440 m/s przy gęstości 1,70 g/cm³[4]. W temperaturze pokojowej jest bardzo stabilny – spala się, nie wybuchając. Do detonacji niezbędne jest użycie zapalnika. Heksogen staje się jednak bardzo wrażliwy w postaci krystalicznej poniżej −4 °C.
Zastosowanie[edytuj | edytuj kod]
Heksogen jest jednym z najpotężniejszych materiałów wybuchowych kruszących. Ma dużą siłę kruszącą, jest stabilny podczas przechowywania i bezpieczny dzięki małej wrażliwości na bodźce mechaniczne[5][4]. Ma szerokie zastosowanie jako militarny materiał wybuchowy, zarówno samodzielnie w postaci różnych ładunków, jak i jako składnik wielu mieszanin. Po dodaniu do niego plastyfikatorów i innych składników powstają plastyczne materiały wybuchowe, takie jak C4, lecz np. Semtex zawiera zamiast niego pentryt. Heksogen jest też składnikiem m.in. A-IX-2, HBX, torpeksu, H-6, heksalu, HTA. Stosowany do napełniania spłonek pobudzających, lontów detonujących i artyleryjskich pocisków małokalibrowych oraz w mieszaninie z trotylem, do napełniania korpusów pocisków artyleryjskich, bomb lotniczych, min i torped[6].
Historia[edytuj | edytuj kod]
Heksogen otrzymano po raz pierwszy w II połowie lat 90. XIX w.[4][5][6] Odkrył go niemiecki chemik i farmaceuta Georg Friedrich Henning (patent nr 104280 z 15 lipca 1898)[7]. Jego szerokie stosowanie rozpoczęło się po opanowaniu bezpiecznych i skutecznych metod syntezy. W czasach II wojny światowej był wykorzystywany w dużych ilościach przez obie walczące strony[5]. Współcześnie jest najważniejszym materiałem wybuchowym o zastosowaniu militarnym[8].
Otrzymywanie[edytuj | edytuj kod]
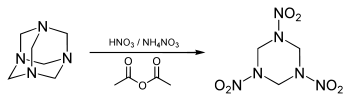
Heksogen otrzymywany jest w reakcji stężonego kwasu azotowego z urotropiną[6]. Uproszczony zapis reakcji[9]:
- (CH2)6N4 + 10HNO3 → (CH2-N-NO2)3 + 3CH2(ONO2)2 + NH4NO3 + 3H2O
Produktami ubocznymi procesu są azotan amonu i diazotan metanodiolu, CH2(ONO2)2. Związki te powstają także w głównej reakcji ubocznej[9]:
- (CH2)6N4 + 16HNO3 → 6CH2(ONO2)2 + 4NH4NO3
Inną metodą syntezy heksogenu jest nitrowanie urotropiny mieszaniną kwasu azotowego i azotanu amonu w obecności bezwodnika octowego (podobnie produkuje się jeszcze silniejszy oktogen).
Przypisy[edytuj | edytuj kod]
- ↑ a b c d Heksogen. [martwy link] The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2012-11-03]. (ang.).[niewiarygodne źródło?]
- ↑ a b Cyclonite, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2012-11-03] (ang.).
- ↑ RDX | Military, Synthetic, Nitroamine | Britannica [online], www.britannica.com, 19 września 2023 [dostęp 2023-10-17] (ang.).
- ↑ a b c J.P. Agrawal, R. Hodgson, Organic Chemistry of Explosives, Wiley, 2006, s. 192–193, DOI: 10.1002/9780470059364, ISBN 978-0-470-02967-1 (ang.).
- ↑ a b c R. Meyer, J. Kohler, A. Homburg, Explosives, wyd. 5, Wiley, 2002, s. 68–71, DOI: 10.1002/3527600515, ISBN 978-3-527-30267-3 (ang.).
- ↑ a b c Andrzej Ciepliński, Ryszard Woźniak: Encyklopedia współczesnej broni palnej (od połowy XIX wieku). Warszawa: Wydawnictwo WiS, 1994, s. 84. ISBN 83-86028-01-7.
- ↑ Cyclotrimethylenetrinitramine (RDX) | Science Toys [online], scitoys.com [dostęp 2023-10-17].
- ↑ J.P. Agrawal, R. Hodgson, Organic Chemistry of Explosives, Wiley, 2006, s. 243–247, DOI: 10.1002/9780470059364, ISBN 978-0-470-02967-1 (ang.).
- ↑ a b K.-M. Luo, S.-H. Lin, J.-G. Chang, T.-H. Huang. Evaluations of kinetic parameters and critical runaway conditions in the reaction system of hexamine-nitric acid to produce RDX in a non-isothermal batch reactor. „Journal of Loss Prevention in the Process Industries”. 15 (2), s. 119–127, 2002. DOI: 10.1016/S0950-4230(01)00027-4.