Kwas cytrynowy
| |||||||||||||||||||||||||||||||||
 kryształy kwasu cytrynowego w świetle spolaryzowanym | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||
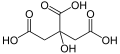
| Wzór sumaryczny |
C6H8O7 | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
HOOC-CH2-C(OH)(COOH)-CH2-COOH | ||||||||||||||||||||||||||||||||
| Masa molowa |
192,12 g/mol | ||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwne ciało krystaliczne o kwaśnym smaku[2] | ||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||
Kwas cytrynowy (łac. Acidum citricum; E330) – organiczny związek chemiczny z grupy hydroksykwasów karboksylowych. Zawiera 3 grupy karboksylowe.
Kwas cytrynowy jest uważany za związek bezpieczny, jednak może powodować uszkodzenia oczu w przypadku bezpośredniego kontaktu. Doniesienia o możliwym działaniu rakotwórczym są całkowicie błędne[4].
Występowanie[edytuj | edytuj kod]
Kwas cytrynowy występuje w niewielkich ilościach w większości organizmów żywych, gdyż spełnia ważną rolę w metabolizmie węglowodanów. Jego forma zjonizowana (cytrynian) jest ważnym produktem przejściowym w cyklu Krebsa (zwanym stąd cyklem kwasu cytrynowego)[2]. W większych ilościach występuje w niektórych owocach, np. w cytrynach[2], w których stanowi nawet do 8% suchej masy (co odpowiada 0,65% masy świeżej cytryny).
Otrzymywanie[edytuj | edytuj kod]
W przemyśle kwas cytrynowy jest otrzymywany głównie przez fermentację cytrynową[2] na pożywce z oczyszczonego cukru lub hydrolizatu skrobi za pomocą kultur kropidlaka czarnego (Aspergillus niger) hodowanego na podłożu o początkowym pH 2,5–3,5[5].
Może być otrzymywany syntetycznie[2].
Można go uzyskać w postaci krystalicznej w formie bezwodnej lub jako monohydrat[6] i w obu tych postaciach jest dostępny w handlu[7][8].
Zastosowanie[edytuj | edytuj kod]
Kwas cytrynowy jest używany jako regulator kwasowości i przeciwutleniacz w produktach spożywczych[2], a także jako kwasowy środek myjący w różnych procesach czyszczących[9][10][11]. Sole kwasu cytrynowego – cytryniany – są stosowane jako leki przy niedoborze określonego metalu w organizmie.
Jest wykorzystywany także w przemyśle farmaceutycznym oraz w gospodarstwie domowym pod nazwą kwasek cytrynowy[2].
Przypisy[edytuj | edytuj kod]
- ↑ a b c d Farmakopea Polska IX, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2011, s. 4574, ISBN 978-83-88157-77-6.
- ↑ a b c d e f g h Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 210, ISBN 83-7183-240-0.
- ↑ Zarchiwizowana kopia. [dostęp 2015-02-15]. [zarchiwizowane z tego adresu (2016-03-04)].
- ↑ Czy kwas cytrynowy (E330) jest rakotwórczy?. Food-Info.net. [dostęp 2009-07-29].
- ↑ Hans Günter Schlegel: Mikrobiologia ogólna. Warszawa: PWN, 2003, s. 412–414. ISBN 83-01-13999-4.
- ↑ CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 3-120, ISBN 978-0-8493-0488-0 (ang.).
- ↑ Citric acid (nr 251275) w katalogu produktów Sigma-Aldrich (Merck). [dostęp 2017-08-07].
- ↑ Citric acid monohydrate (nr C1909) w katalogu produktów Sigma-Aldrich (Merck). [dostęp 2017-08-07].
- ↑ Liu, Charles; Caothien, Scott; Hayes, Jennifer; Caothuy, Tom; Otoyo, Takehiko; Ogawa, Takashi: Membrane Chemical Cleaning: From Art to Science. American Water Works Association, 2001. [dostęp 2014-04-08]. [zarchiwizowane z tego adresu (2015-09-24)].
- ↑ High-throughput process development for design of cleaning-in-place protocols. GE Healthcare, 2010. [dostęp 2014-04-08]. [zarchiwizowane z tego adresu (2014-04-08)].
- ↑ Leonid Shnayder, David Greene, Ryoichi Haga: CIP (Cleaning In Place). GCEM / QMT, 2006. [dostęp 2014-04-08]. [zarchiwizowane z tego adresu (2014-04-08)].