Kuban (węglowodór)
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny |
C8H8 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
104,15 g/mol | ||||||||||||||||||
| Wygląd |
krystaliczne ciało stałe | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | |||||||||||||||||||
| PubChem | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Podobne związki | |||||||||||||||||||
| Podobne związki | |||||||||||||||||||
| Pochodne nitrowe | |||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||
Kuban (z gr. κύβος sześcian), C
8H
8 – organiczny związek chemiczny z grupy alifatycznych węglowodorów policyklicznych, w którym atomy węgla są ułożone w narożach sześcianu, a do każdego atomu węgla jest przyłączony jeden atom wodoru. Jest jednym z węglowodorów platońskich. Jest krystaliczną substancją.
Zanim został wytworzony, naukowcy uważali, że sześcienne cząstki mogą istnieć tylko w teorii. Sądzili, że kuban nie był możliwy do zsyntetyzowania, ponieważ wiązania pod kątem 90 stopni są wtedy niezwykle silnie naprężone, co może powodować niestabilność cząsteczki. Wbrew temu raz zsyntetyzowana cząsteczka kubanu jest stabilna.
Kuban i jego związki mają wiele ciekawych i ważnych właściwości. Kąt prosty pomiędzy wiązaniami powoduje ich silne naprężenie, co skutkuje dużą ilością energii zgromadzoną w tych wiązaniach. Możliwe, że będzie można produkować wysokoenergetyczne paliwa i materiały wybuchowe o dużej gęstości na bazie kubanu. Kuban posiada także największą wśród węglowodorów gęstość, co umożliwia gromadzenie w nim większych ilości energii. Naukowcy rozważają możliwość zastosowania kubanu i innych sześciennych cząstek w medycynie i nanotechnologii.
Synteza[edytuj | edytuj kod]
Po raz pierwszy kuban został zsyntetyzowany przez Philipa Eatona, profesora chemii w Uniwersytecie Chicago w 1964[3] roku. Oryginalną syntezę rozpoczyna się od 2-cyklopentenonu[4][5].
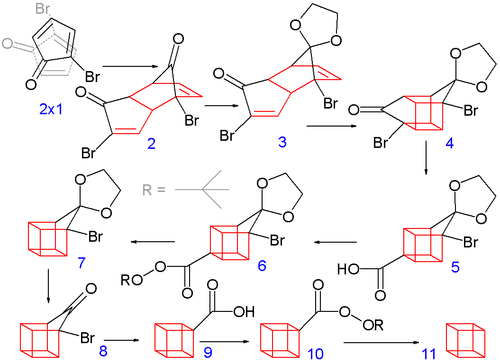
Reakcja cyklopent-2-enonu (rys. 1) z NBS w tetrachlorku węgla powoduje podstawienie bromu w pozycji allilowej (rys. 2). Dalsze bromowanie przy użyciu bromu w mieszance pentanu z chlorometanem prowadzi do pochodnej tribromowej (rys. 3). Następnie poprzez eliminację dwóch równoważników bromowodoru przy użyciu dietyloaminy w środowisku eteru dietylowego prowadzi do uzyskania 2-bromocyklopenta-2,4-dien-1-onu (rys. 4).
Spontaniczna reakcja Dielsa-Aldera przebiega analogicznie do dimeryzacji cyklopentadienu (rys. 2). Aby synteza przebiegła pomyślnie musi powstać jedynie izomer endo. Dzieje się tak, gdyż atomy bromu ustawiają się w przestrzeni możliwie najdalej od siebie i grupy karbonylowej[6]. Obie grupy karbonylowe zabezpiecza się przeprowadzając je w acetale poprzez reakcję z glikolem etylenowym i kwasem p-toluenosulfonowym w benzenie, następnie jeden z acetali jest selektywnie odbezpieczany przy użyciu wodnego roztworu kwasu solnego (rys. 3).
Na kolejnym etapie poprzez fotochemiczną reakcję cykloaddycji uzyskuje się strukturę w kształcie klatki (rys. 4). Kolejną „krawędź” uzyskuje się z grupy bromoketonowej wskutek przegrupowania Favorskiego w środowisku wodorotlenku potasu (rys. 5). Następnie przeprowadza się dwuetapową reakcję dekarboksylacji (rys. 7) (przez pochodną nadtleno-tert-butylową (rys. 6)).
Drugi acetal zostaje odbezpieczony (rys. 8) i ponowne przegrupowanie Faworskiego prowadzi do karboksylowej pochodnej kubanu (rys. 9). Ponowna dwuetapowa dekarboksylacja prowadzi do finalnego produktu (rys. 11).
Przypisy[edytuj | edytuj kod]
- ↑ a b P-23.7 Zachowane nazwy macierzystych wodorków von Baeyera, [w:] Henri A. Favre, Warren H. Powell, Nomenklatura związków organicznych. Rekomendacje IUPAC i nazwy preferowane 2013, Komisja Terminologii Chemicznej Polskiego Towarzystwa Chemicznego (tłum.), wyd. 5, Narodowy Komitet Międzynarodowej Unii Chemii Czystej i Stosowanej, [2023], s. 159.
- ↑ a b c Witold Mizerski: Tablice chemiczne. Warszawa: Wydawnictwo Adamantan, 2008, s. 206. ISBN 978-83-7350-105-8.
- ↑ Witold Mizerski: Tablice chemiczne. Warszawa: Wydawnictwo Adamantan, 2008, s. 252. ISBN 978-83-7350-105-8.
- ↑ Philip E. Eaton, Thomas W. Cole, The Cubane System, „Journal of the American Chemical Society”, 86 (5), 1964, s. 962–964, DOI: 10.1021/ja01059a072 [dostęp 2023-08-17] (ang.).
- ↑ Philip E. Eaton, Thomas W. Cole, Cubane, „Journal of the American Chemical Society”, 86 (15), 1964, s. 3157–3158, DOI: 10.1021/ja01069a041 [dostęp 2023-08-17] (ang.).
- ↑ John McMurry: Chemia organiczna 3. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 477. ISBN 83-01-14403-3.