Węgiel (pierwiastek)
| bor ← węgiel → azot | |||||||||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||||||||
| czarny (grafit, fuleren) bezbarwny (diament) | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
Widmo emisyjne węgla | |||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||
| Nazwa, symbol, l.a. |
węgiel, C, 6 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupa, okres, blok | |||||||||||||||||||||||||||||||||||||
| Stopień utlenienia |
II, IV | ||||||||||||||||||||||||||||||||||||
| Właściwości metaliczne | |||||||||||||||||||||||||||||||||||||
| Właściwości tlenków |
lekko kwaśne | ||||||||||||||||||||||||||||||||||||
| Masa atomowa | |||||||||||||||||||||||||||||||||||||
| Stan skupienia |
stały | ||||||||||||||||||||||||||||||||||||
| Gęstość | |||||||||||||||||||||||||||||||||||||
| Temperatura topnienia |
diament: 4440 °C (122 tys. atm)[1] | ||||||||||||||||||||||||||||||||||||
| Temperatura wrzenia |
3852 °C (sublimacja)[1] | ||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą warunków normalnych (0 °C, 1013,25 hPa) | |||||||||||||||||||||||||||||||||||||
Węgiel (C, łac. carboneum[5]) – pierwiastek chemiczny o liczbie atomowej 6, niemetal[6][7][8][b] z bloku p układu okresowego. Należy do grupy 14. Ma cztery elektrony walencyjne. Istnieją trzy naturalnie występujące izotopy węgla, 12
C oraz 13
C są stabilne, natomiast izotop 14
C jest promieniotwórczy o czasie połowicznego rozpadu równym około 5700 lat[10]. Węgiel jest jednym z niewielu pierwiastków znanych w starożytności[11][12]. Jako pierwszy polską nazwę – węgiel – zaproponował Filip Neriusz Walter.
Węgiel ma odmiany alotropowe, z czego najbardziej znane to grafit oraz diament. Właściwości fizyczne węgla zależą od odmiany w jakiej występuje. Na przykład diament jest przezroczysty, natomiast grafit jest nieprzezroczysty i czarny. Diament jest jednym z najtwardszych materiałów na Ziemi, podczas gdy grafitem można pisać na papierze, co wykorzystuje się w ołówkach. Diament ma bardzo niskie przewodnictwo właściwe, a grafit jest dobrym przewodnikiem elektrycznym. Grafen ma najwyższą przewodność cieplną ze wszystkich znanych materiałów, a diament, kolejna forma węgla, namacalna, drugą w kolejności, w warunkach normalnych. Alotropy węgla są w warunkach normalnych ciałami stałymi. Innymi alotropami węgla są: fuleren oraz formy poliynowe jak cyklo[18]węgiel bądź karbin (są doniesienia o istnieniu liniowego łańcucha węgla). Niektórzy uważają, że alotropami są także: nanocebulka, nanorurka, nanopianka, choć to raczej nazwy struktur supramolekularnych, a nie alotropów.
Wszystkie formy występowania węgla są wysoce stabilne, wymagają wysokiej temperatury żeby reagować choćby z tlenem. Największe ilości nieorganicznego węgla występują w postaci skał wapiennych, dolomitów oraz dwutlenku węgla, natomiast znaczne ilości węgla organicznego znajdują się w paliwach kopalnych. Węgiel tworzy więcej związków niż wszystkie inne pierwiastki chemiczne. Liczba organicznych związków węgla zarejestrowanych w bazie Beilstein w roku 2008 wynosiła 10 853 341[13], jednak liczba jego potencjalnych związków jest nieograniczona. Węgiel znajduje się na czwartym miejscu częstości występowania pierwiastków we Wszechświecie, po wodorze, helu i tlenie. Jest obecny we wszystkich organizmach. W organizmie człowieka jest drugim (po tlenie) co do liczności pierwiastkiem ze względu na jego masę (ok. 18,5%)[14]. Ta ilość w połączeniu z różnorodnością związków organicznych czyni pierwiastek chemiczny węgiel chemiczną podstawą życia.
Charakterystyka[edytuj | edytuj kod]

Różne odmiany alotropowe węgla wykazują bardzo różne właściwości: na przykład diament jest najtwardszą naturalnie występującą substancją, grafit jedną z substancji o najmniejszej twardości. Ponadto węgiel ma powinowactwo do tworzenia wiązań chemicznych z innymi małymi atomami, w tym z innymi atomami węgla, oraz tworzenia wielu wiązań kowalencyjnych z tymi atomami, w wyniku czego związki zawierające w swojej strukturze węgiel stanowią znaczną część wszystkich znanych związków – ich liczba dochodzi do dziesięciu milionów[15]. Węgiel ma także najwyższą temperaturę topnienia ze wszystkich pierwiastków[16]. Przy ciśnieniu atmosferycznym nie występuje w stanie ciekłym, lecz podczas ogrzewania sublimuje w temperaturze 3852 °C[1]; jego punkt potrójny występuje przy ok. 10,3 MPa (102 atm)[1]. Niezależnie od odmian alotropowych pozostaje ciałem stałym w wyższych temperaturach, niż metale o najwyższych temperaturach topnienia (wolfram i ren). Jednak termodynamicznie węgiel jest podatny na utlenianie, znacznie bardziej niż żelazo lub miedź, które są słabymi reduktorami w temperaturze pokojowej.
Związki zawierające węgiel są podstawą życia na Ziemi, a cykl węglowo-azotowo-tlenowy dostarcza część energii wytwarzanej przez Słońce i inne gwiazdy. Mimo różnorodności związków węgla większość jego form jest stosunkowo słabo reaktywna w warunkach normalnych. Nie reaguje z kwasem siarkowym, kwasem solnym, chlorem ani zasadami. W podwyższonej temperaturze węgiel reaguje z tlenem, tworząc tlenki węgla, oraz redukuje wiele tlenków metali, takich jak tlenek żelaza, do wolnego metalu. Ta reakcja egzotermiczna jest wykorzystywana w hutnictwie żelaza, stali do kontroli zawartości węgla w stali:
- Fe
3O
4 + 4C
(s) → 3Fe
(s) + 4CO
(g)↑
Z siarką tworzy dwusiarczek węgla, a z parą wodną tlenek węgla i wodór:
- C
(s) + H
2O
(g) → CO
(g) + H
2
(g)
Węgiel reaguje z niektórymi metalami, tworząc węgliki, w tym węglik żelaza (cementyt) czy węglik wolframu, który dzięki swojej twardości jest używany w różnego rodzaju narzędziach tnących.
Odmiany alotropowe węgla[edytuj | edytuj kod]
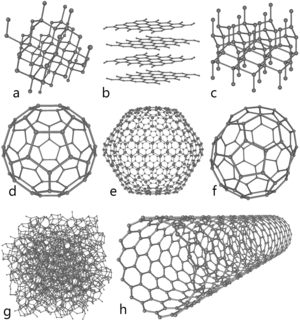
a) diament, b) grafit, c) lonsdaleit (domniemana struktura), d) fuleren C60 e) fuleren C540,
f) fuleren C70, g) węgiel bezpostaciowy (amorficzny), h) nanorurka
Węgiel występuje w odmianach alotropowych np.:
Występowanie[edytuj | edytuj kod]
Zawartość węgla w skorupie ziemskiej wynosi 0,018%. Spotykany jest:
- w postaci pierwiastka chemicznego: grafit, diament, fulereny, sadza (zanieczyszczony węgiel bezpostaciowy)
- w postaci związków chemicznych:
- w mieszaninach organicznych związków węgla, jakimi są paliwa kopalne:
Obieg węgla[edytuj | edytuj kod]
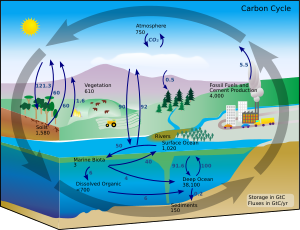
W warunkach ziemskich zmiana jednego związku w drugi jest rzadka, jednak ilość węgla na Ziemi jest stała. Dlatego musi istnieć proces powodujący utrzymanie równej ilości węgla w różnych jej częściach. Ścieżki, jakimi „wędruje” węgiel, tworzą obieg węgla w przyrodzie. Rośliny pochłaniają dwutlenek węgla z powietrza i używają go do produkcji biomasy w procesie fotosyntezy lub cyklu Calvina. Część biomasy produkowanej przez rośliny zostaje zjedzona przez zwierzęta, podczas gdy część węgla jest wydychana w postaci dwutlenku węgla.
Związki węgla[edytuj | edytuj kod]
Związki organiczne[edytuj | edytuj kod]
Węgiel ma zdolność do tworzenia bardzo długich łańcuchów zawierających wiązanie C−C. Zdolność ta nosi nazwę katenacji. Wiązanie węgiel-węgiel jest bardzo silne i stabilne.
Ta zdolność pozwala węglowi tworzyć praktycznie nieskończoną liczbę związków. Liczba związków zawierających węgiel w swojej strukturze jest większa niż wszystkich pozostałych związków nie zawierających węgla (nie licząc związków zawierających wodór, gdyż praktycznie każdy związek organiczny zawiera atom wodoru).
Najprostszymi związkami organicznymi są węglowodory – związki zawierające w swojej strukturze tylko atomy węgla i wodoru. Długość łańcucha, boczne łańcuchy oraz grupy funkcyjne wpływają na właściwości związku.

Węgiel występuje w każdym organizmie żywym oraz jest podstawą chemii organicznej. Węglowodory to grupa palnych związków, które odgrywają istotną rolę w przemyśle polimerowym, petrochemicznym oraz paliw kopalnych.
Gdy w związku obok węgla i wodoru występuje tlen, tworzy się wiele ważnych biologicznie grup związków, jak cukier, chityna, alkohole, tłuszcze, zapachowe estry, karotenoidy oraz terpeny. Związki zawierające azot tworzą alkaloidy, aminokwasy, zawierające siarkę antybiotyki. Związki zawierające fosfor tworzą DNA, RNA oraz ATP, najważniejszy przenośnik energii w komórce.
Związki nieorganiczne[edytuj | edytuj kod]
Spośród nieorganicznych związków węgla duże znaczenie mają dwutlenek węgla, tlenek węgla, kwas węglowy, węglany oraz węgliki. Powszechnie stosowany jest w stopach z żelazem (stal i żeliwo). W związkach węgiel jest zazwyczaj czterowartościowy, rzadko dwuwartościowy (np. w tlenku węgla oraz związkach kompleksowych). Występuje na rozmaitych stopniach utlenienia w zakresie od −IV do IV.
Do najważniejszych tlenków węgla należą tlenek, dwutlenek i podtlenek.
Zastosowanie węgla[edytuj | edytuj kod]
Jako paliwo kopalne i surowiec do wytwarzania paliw, węgiel jest zawarty m.in. w w. kamiennym, w. brunatnym, gazie ziemnym i ropie naftowej.
Naturalna zawartość izotopu 14
C wykorzystywana jest do datowania radiowęglowego. W czasie życia w organizmie przyswajane są związki z węglem 14
C i odkładane wewnątrz tkanek. Po śmierci węgiel rozpada się. Podczas określania wieku organizmu mierzy się proporcję węgla 14
C do całkowitej ilości węgla.
Grafit jest stosowany m.in. w poligrafii, do produkcji ołówków oraz jako jedna z elektrod w spawalnictwie.
Diamenty są surowcem do tworzenia brylantów - kamieni szlachetnych stosowanych w jubilerstwie. Ze względu na swoją wysoką twardość są stosowane w narzędziach (w tym diamenty syntetyczne[17]) do skrawania, szlifowania, wiercenia. Używa się do produkcji tranzystorów polowych. Wyzyskując mechaniczne własności np. w kowadłach diamentowych.
Węgiel aktywowany jest używany w medycynie przy zatruciach oraz do procesów oczyszczania cieczy i gazów. Sadza jest ważnym składnikiem wielu procesów produkcyjnych.
Uwagi[edytuj | edytuj kod]
- ↑ Podana wartość stanowi przybliżoną standardową względną masę atomową (ang. abridged standard atomic weight) publikowaną wraz ze standardową względną masą atomową, która wynosi [12,0096; 12,0116] (patrz:
 Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)). Z uwagi na zmienność abundancji izotopów pierwiastka w naturze, wartości w nawiasach klamrowych stanowią zakres wartości względnej masy atomowej dla naturalnych źródeł tego pierwiastka (patrz:
Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)). Z uwagi na zmienność abundancji izotopów pierwiastka w naturze, wartości w nawiasach klamrowych stanowią zakres wartości względnej masy atomowej dla naturalnych źródeł tego pierwiastka (patrz:  Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)).
Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)).
- ↑ Niektórzy autorzy klasyfikują go jako półmetal[9].
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 4-56, ISBN 978-0-8493-0488-0 (ang.).
- ↑ Carbon, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 8040 [dostęp 2011-10-01] (niem. • ang.).
- ↑ Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.).
- ↑ a b CRC Handbook of Chemistry and Physics, David R. Lide (red.), wyd. 88, Boca Raton: CRC Press, 2007, s. 4-8, ISBN 978-0-8493-0488-0 (ang.).
- ↑ węgiel, [w:] Encyklopedia PWN [dostęp 2024-01-06].
- ↑ Geoff Rayner-Canham, Tina Overton: Descriptive Inorganic Chemistry. W. H. Freeman and Company, 2010, s. 29. ISBN 978-1-4292-2434-5.
- ↑ D. D. Ebbing, S. D. Gammon: General Chemistry. Houghton Miffin Company, 2007, s. 52. ISBN 0-618-85748-6.
- ↑ P. Enghag: Encyclopedia of the Elements. Technical Data - History - Processing - Applications. Wiley, 204, s. 914. ISBN 978-3-527-30666-4.
- ↑ K.C. Nicolaou, T. Montagnon: Molecules that changed the world. A brief history of the art and science of synthesis and its impact on society. Wiley, 2008, s. 4. ISBN 978-3-527-30983-2.
- ↑ Carbon – Naturally occurring isotopes. WebElements Periodic Table. [dostęp 2007-12-08].
- ↑ Periodic Table: Date of Discovery. [dostęp 2007-03-13].
- ↑ Timeline of Element Discovery. [dostęp 2007-03-13].
- ↑ CrossFire Beilstein Database 2008/03, Elsevier Information Systems GmbH.
- ↑ Biological Abundance of Elements. [dostęp 2007-12-06].
- ↑ Chemistry Operations: Carbon. Los Alamos National Laboratory, 15 grudnia 2003. [dostęp 2013-06-25].
- ↑ Melting point: periodicity. Webelements.com. [dostęp 2015-09-02].
- ↑ Diamenty syntetyczne: czym są i jak rozpoznać sztuczne diamenty? [online], sklepjubilerski.com [dostęp 2024-04-26] (pol.).
| Układ okresowy pierwiastków | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3[i] | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | ✱ | |||||||||||||||||||||||||||||||||||||||||
| ✱ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | ...[ii] | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||

