Trąd
| Lepra | |
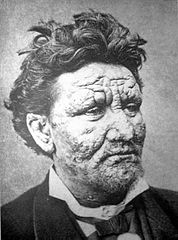 24-letni mężczyzna z Norwegii chory na trąd, 1886 | |
| Klasyfikacje | |
| DiseasesDB | |
|---|---|
| OMIM | |
| MedlinePlus | |
| MeSH | |
Trąd, lepra, choroba Hansena (HD) – przewlekła choroba zakaźna występująca u ludzi i zwierząt, wywołana przez prątki Mycobacterium leprae[1], bakterię odkrytą w 1873 roku przez norweskiego naukowca Armauera Hansena oraz Mycobacterium lepromatosis odkrytą w 2008 roku[2]. Występuje w dwóch postaciach: lepromatycznej (lepra lepromatosa tuberosa) i tuberkuloidowej (lepra tuberculoides). Odmiana lepromatyczna jest zaraźliwa, a jej objawy to guzowate krosty podobne do występujących w innych infekcjach i alergiach. Postać tuberkuloidowa jest mniej zaraźliwa, ale groźniejsza dla samego zarażonego: początkowo pojawiają się plamy na skórze, stopniowo utrata czucia, szczególnie w palcach nóg i rąk, nieleczona prowadzi do zwyrodnień i utraty tkanki.
Do niedawna badania nad trądem były bardzo trudne, wywołującego go bowiem mikroba nie można hodować w warunkach laboratoryjnych. Odkryto jednak, że na trąd cierpią także amerykańskie pancerniki (ze względu na stosunkowo niską temperaturę ciała) i od tej pory zwierzęta te wykorzystuje się w doświadczeniach. W 2005 r. grupa kierowana przez Marca Monota z paryskiego Instytutu Pasteura na podstawie badań DNA bakterii Mycobacterium leprae odtworzyła prawdopodobny scenariusz rozprzestrzeniania się trądu na kuli ziemskiej. W trakcie badań 175 próbek z 21 krajów świata wydzielono jedynie 4 polimorfizmy różnicujące szczepy. Na pierwszy, najrzadszy szczep można natrafić w Etiopii, na Nowej Kaledonii i w Nepalu, drugi rozpowszechniony jest na pacyficznych wybrzeżach Azji i w Afryce wschodniej (Madagaskarze i Mozambiku), trzeci w Europie i obu Amerykach, zaś czwarty na Karaibach i w Afryce Zachodniej.
Przebieg choroby[edytuj | edytuj kod]
Początkowo zakażenie przebiega bezobjawowo i zazwyczaj utrzymuje się w takiej formie przez okres od 5 do nawet 20 lat[1]. Rozróżnia się dwa główne typy choroby w zależności od ilości obecnych prątków: postać tuberkuloidowa – typ z niewielką ilością prątków i postać lepromatyczna – typ ze znaczną ilością prątków[3].
Postać tuberkuloidowa cechuje się obecnością skąpych i odgraniczonych odbarwień skóry o niesymetrycznym ułożeniu oraz uszkodzeniem powierzchownych nerwów obwodowych, które prowadzi do wyczuwalnego i widocznego ich pogrubienia. Neuralgia prowadzi do zaburzeń czucia, co sprzyja urazom, a także do zaników mięśniowych i deformacji kostno-stawowych[4].
Postać lepromatyczna cechuje się symetrycznymi naciekami w tkankach. Obserwuje się różne zmiany skórne, w tym odbarwienia, grudki i tarczowate nacieki, które mogą niszczyć głębsze tkanki. Zmiany dotyczą również błony śluzowej nosa, którego wydzielina jest mocno zakaźna. Dochodzi do deformacji małżowin usznych. W obrębie oczu pojawia się zapalenie rogówki lub spojówek. Obrzęk skóry na czole, na granicy z wargami i uszami, zapadnięcie czubka nosa powoduje deformacje twarzy nazywaną lwią twarzą. Obserwuje się zaburzenia czucia i uszkodzenia kości[4].
Istnieją postacie pośrednie[4].
Epidemiologia[edytuj | edytuj kod]
W 2012 r. na całym świecie stwierdzono 189 tys. przypadków przewlekłego trądu, a nowych zachorowań było 230 tys.[1] Liczba osób przewlekle chorych na trąd zmniejszyła się z około 5,2 mln w latach 80. XX wieku[1][5][6]. Choroba częściej występuje wśród osób żyjących w ubóstwie. Większość nowych zachorowań występuje w 16 krajach, ponad połowa w Indiach[1][3]. W ciągu ostatnich 20 lat ponad 16 milionów ludzi zostało wyleczonych z trądu[1].
Droga zakażenia[edytuj | edytuj kod]
Do zakażenia dochodzi poprzez bliskie kontakty pomiędzy ludźmi, prawdopodobnie przez błony śluzowe i skórę. W postaci lepromatycznej możliwa jest droga kropelkowa. Choroba nie jest wysoce zaraźliwa[3]. Postać tuberkuloidowa nie jest zakaźna[4].
Diagnoza[edytuj | edytuj kod]
Podstawą do rozpoznania jest stwierdzenie typowych zmian skórnych z utratą nerwów oraz stwierdzenie prątków kwasoopornych w wycinkach skóry. Typ z niewielką ilością prątków i typ ze znaczną ilością prątków rozróżnia się na podstawie liczby obecnych słabo zabarwionych, pozbawionych czucia obszarów skóry, w przypadku typu z niewielką ilością prątków występuje ich pięć lub mniej, zaś w przypadku typu ze znaczną ilością prątków, występuje ich więcej niż pięć[3]. Diagnozę potwierdza się poprzez stwierdzenie prątków kwasoopornych w wycinkach skóry i błony śluzowej, szczególnie nosa, bioptatach zmienionych miejsc lub zeskrobinach lub przez wykrycie DNA bakterii za pomocą łańcuchowej reakcji polimerazy (PCR)[3]. W przypadkach wątpliwych przydatna może być technika hybrydyzacji in situ z użyciem sondy molekularnej reagującej z materiałem genetycznym prątka[7].
Testy serologiczne mają mniejsze znaczenie. Przeciwciała są wykrywane w postaci lepromatycznej, jednak są niewykrywalne w postaci tuberkuloidowej[7].
Bywają stosowane testy skórne, które na ogół są dodatnie u chorych z postacią tuberkuloidową, jednak może być dodatni u ludzi z terenów endemicznych. W postaci lepromatycznej zwykle jest ujemny[7].
Leczenie[edytuj | edytuj kod]
Trąd jest uleczalny przy zastosowaniu właściwego leczenia[1]. Leczenie typu choroby z niewielką ilością prątków odbywa się za pomocą skojarzenia dapsonu i ryfampicyny przez 6 miesięcy[3]. Leczenie typu choroby ze znaczną ilością prątków składa się z ryfampicyny, dapsonu i klofazyminy przez 24 miesiące lub do momentu niewykrywania żywych prątków[7]. Monoterapia lekami przeciwprątkowymi prowadzi do szybkiego powstania lekooporności[7]. Podstawowe leki są zapewniane bezpłatnie przez Światową Organizację Zdrowia (WHO)[1]. Można też stosować szereg innych antybiotyków[3]. W owrzodzeniach troficznych spowodowanych trądem skuteczne jest stosowanie osocza bogatopłytkowego[8].
Historia[edytuj | edytuj kod]
Trąd dotyka ludzkość od tysięcy lat[3]. Łacińska nazwa choroby lepra pochodzi od stgr. λέπρα [léprā], które oznacza stan łuszczenia[9], zaś nazwa „choroba Hansena” pochodzi od lekarza Gerharda Armauera Hansena[3], odkrywcy prątka trądu.
W Polsce trąd pojawił się w drugiej połowie XIII wieku. Swoje apogeum choroba ta osiągnęła w wieku XV. Trędowatych leczono w Krakowie, w Szpitalu św. Walentego (powstał ok. 1327 r.) i w Szpitalu św. Leonarda (powstał w 1443 r.). Pod nazwą „trądu” współcześni rozumieli także inne choroby skórne, które w wymienionych szpitalach były również leczone. Ogniska trądu na terenie Polski wygasły w XVII wieku. Wtedy też leprozoria zamknięto lub zamieniono na szpitale dla „zapowietrzonych” (chorych zakaźnie) albo przytułki dla ubogich[10].
Liczba chorych w Europie znacznie zmniejszyła się po epidemii „czarnej śmierci” (dżumy) w XIV wieku, podczas której zmarła większość zakażonych. W następnych stuleciach przypadki zachorowań zdarzały się stosunkowo rzadko, a odkrycie w latach 30. XX wieku pierwszego, jeszcze mało skutecznego lekarstwa przeciw trądowi (dapsonu), przyniosło skutek w postaci jego ostatecznego zniknięcia. Ostatnie leprozorium w państwach Unii Europejskiej mieści się w Rumunii na skraju mokradeł delty Dunaju w osadzie Tichilești[potrzebny przypis][11].
Izolowanie chorych w koloniach dla trędowatych nadal ma miejsce w krajach takich jak Indie, gdzie istnieje ponad tysiąc kolonii[12], Chiny, gdzie jest ich kilkaset[13], oraz w krajach Afryki[14]. Niemniej jednak większość kolonii zamknięto[14]. Przez większość ludzkich dziejów trąd wiązał się z piętnem społecznym[1], które nadal stanowi barierę w zakresie zgłaszania choroby i wdrożenia wczesnego leczenia. Światowy Dzień Trędowatych ustanowiono w 1954 roku, aby zwrócić uwagę na osoby chore na trąd[15].
W 2021 roku odkryto trąd również u dzikich szympansów[16].
W Bergen mieści się Muzeum Trądu (Lapramuseet). Położone jest w zabytkowym szpitalu Św. Jerzego, w którym w 1873 roku Armauer Hansen wyizolował prątek trądu[potrzebny przypis].
Klasyfikacja ICD10[edytuj | edytuj kod]
| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: A30 | Trąd [choroba Hansena] |
| ICD-10: A30.0 | Trąd, nieokreślony |
| ICD-10: A30.1 | Trąd tuberkuloidowy |
| ICD-10: A30.2 | Trąd graniczny tuberkuloidowy |
| ICD-10: A30.3 | Trąd graniczny |
| ICD-10: A30.4 | Trąd graniczny lepromatyczny |
| ICD-10: A30.5 | Trąd lepromatyczny |
| ICD-10: A30.8 | Inne postacie trądu |
| ICD-10: A30.9 | Trąd, nieokreślony |
| ICD-10: B92 | Następstwa trądu |
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e f g h i WHO: Leprosy. 2015-05. [dostęp 2015-08-18]. [zarchiwizowane z tego adresu (2015-08-18)].
- ↑ Xiang Y. Han i inni, A new Mycobacterium species causing diffuse lepromatous leprosy, „American Journal of Clinical Pathology”, 130 (6), 2008, s. 856–864, DOI: 10.1309/AJCPP72FJZZRRVMM, PMID: 19019760 (ang.).
- ↑ a b c d e f g h i Koichi Suzuki i inni, Current status of leprosy: epidemiology, basic science and clinical perspectives, „The Journal of Dermatology”, 39 (2), 2012, s. 121–129, DOI: 10.1111/j.1346-8138.2011.01370.x, PMID: 219732377 (ang.).
- ↑ a b c d Cianciara i Juszczyk 2007 ↓, s. 463.
- ↑ Global leprosy situation, 2012 / Situation mondiale de la lèpre, 2012, „Releve Epidemiologique Hebdomadaire”, 87 (34), 2012, s. 317–328, PMID: 22919737 (ang. • fr.).
- ↑ Laura C. Rodrigues, Diana Nj Lockwood, Leprosy now: epidemiology, progress, challenges, and research gaps, „The Lancet. Infectious Diseases”, 11 (6), 2011, s. 464–470, DOI: 10.1016/S1473-3099(11)70006-8, PMID: 21616456 (ang.).
- ↑ a b c d e Cianciara i Juszczyk 2007 ↓, s. 464.
- ↑ V. Anandan i inni, Platelet Rich Plasma: Efficacy in Treating Trophic Ulcers in Leprosy, „J. Clin. Diagn. Res.”, 10 (10), 2016, WC06–WC09, DOI: 10.7860/JCDR/2016/21899.8758, PMID: 27891436, PMCID: PMC5121774 (ang.).
- ↑ Frederick C. Lendrum, The Name "Leprosy", „The American Journal of Tropical Medicine and Hygiene”, 1 (6), 1952, s. 999–1008, DOI: 10.4269/ajtmh.1952.1.999, PMID: 12996752, JSTOR: 24234298 (ang.).
- ↑ Marek Żukow-Karczewski, Jak w Krakowie chorowano, „Gazeta Krakowska”, 4 VI 1993 r., nr 127 (13739).
- ↑ Piotr Cywiński, Kolonia przeklętych [online], wprost.pl, 21 marca 2004 [dostęp 2019-06-17].
- ↑ Walsh F: The hidden suffering of India's lepers. [dostęp 2016-02-06].
- ↑ Lyn TE: Ignorance breeds leper colonies in China. [dostęp 2010-01-31]. [zarchiwizowane z tego adresu (2010-04-08)].
- ↑ a b Joseph P. Byrne: Encyclopedia of pestilence, pandemics, and plagues. Westport, Conn.[u.a.]: Greenwood Press, 2008, s. 351. ISBN 978-0-313-34102-1.
- ↑ Dorothy McMenamin: Leprosy and stigma in the South Pacific : a region-by-region history with first person accounts. Jefferson, N.C.: McFarland, 2011, s. 17. ISBN 978-0-7864-6323-7.
- ↑ Kimberley J. Hockings i inni. Leprosy in wild chimpanzees. „Nature”, 2021-10-13. ISSN 1476-4687. (ang.).
Bibliografia[edytuj | edytuj kod]
- Janusz Cianciara, Jacek Juszczyk: Choroby zakaźne i pasożytnicze. Lublin: CZELEJ, 2007. ISBN 978-83-60608-34-0.
