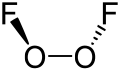Difluorek ditlenu
| |||||||||||||
| |||||||||||||
| Ogólne informacje | |||||||||||||
| Wzór sumaryczny |
F2O2 | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
O2F2, FOOF | ||||||||||||
| Masa molowa |
70,00 g/mol | ||||||||||||
| Wygląd |
pomarańczowe ciało stałe (poniżej −163 °C) | ||||||||||||
| Identyfikacja | |||||||||||||
| Numer CAS | |||||||||||||
| PubChem | |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| |||||||||||||
| Podobne związki | |||||||||||||
| Podobne związki | |||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||
Difluorek ditlenu, O
2F
2 – nieorganiczny związek chemiczny, występuje pod postacią pomarańczowego ciała stałego, które w temperaturze −163 °C topi się, tworząc ciecz czerwonej barwy[3]. Jest silnym utleniaczem i rozkłada się do OF
2 i tlenu już w temperaturze −160 °C (4% na dzień)[4].
Otrzymywanie[edytuj | edytuj kod]
Difluorek ditlenu może być otrzymany poprzez poddanie mieszaniny gazowego fluoru i tlenu w stosunku 1:1 przy niskim ciśnieniu (17 mmHg jest optymalne) wyładowaniom elektrycznym (25–30 mA, 2,1–2,4 kV). Jest to w zasadzie metoda pierwszej syntezy związku, dokonanej w 1933 roku przez Otto Ruffa[5]. Inna synteza wymaga zmieszania O
2 i F
2 w naczyniu ze stali nierdzewnej schłodzonym do temperatury −196 °C, a następnie wystawienie pierwiastków na kilkugodzinne promieniowanie hamowania o energii 3 MeV.
- O
2 + F
2 → O
2F
2
Budowa[edytuj | edytuj kod]
W F
2O
2 tlen posiada nietypowy dla niego +1 stopień utlenienia. W większości związków tlen posiada −2 stopień utlenienia.

Struktura difluorku ditlenu przypomina strukturę nadtlenku wodoru, H
2O
2, w której kąt dwuścienny zbliża się do wartości 90°. Geometria ta jest zgodna z przewidywaniami teorii VSEPR. Długość wiązania O–O jest zbliżona do 120,7 pm, która jest długością wiązania O=O w cząsteczkowym tlenie, O
2[6].
Reaktywność[edytuj | edytuj kod]
Nadrzędną właściwością tego niestabilnego związku jest jego siła utleniająca, pomimo faktu, że wszystkie reakcje muszą przebiegać w temperaturze bliskiej −100 °C[7]. Z BF
3 i PF
5 daje odpowiednie sole dioksygenylowe[8][4]:
- 2O
2F
2 + 2PF
5 → 2[O
2]+
[PF
6]−
+ F
2
Reakcja taka może przekształcać tlenki uranu, plutonu i neptunu w odpowiednie heksafluorki[2].
Przypisy[edytuj | edytuj kod]
- ↑ a b c Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 321, ISBN 978-0-85404-438-2 (ang.).
- ↑ a b c Encyclopedia of inorganic chemistry. Chichester: Wiley, 2005. ISBN 978-0-470-86078-6. (ang.).
- ↑ A.D. Kirshenbaum, A.V. Grosse. Ozone Fluoride or Trioxygen Difluoride, O3F2. „Journal of the American Chemical Society”. 81 (6), s. 1277, 1959. DOI: 10.1021/ja01515a003. (ang.).
- ↑ a b Egon. Wiberg, Nils. Wiberg, A. F. (Arnold Frederick) Holleman: Inorganic chemistr. San Diego: Academic Press, 2001. ISBN 0-12-352651-5. (ang.).
- ↑ O. Ruff, W. Mensel. Neue Sauerstofffluoride: O2F2 und OF. „Zeitschrift für anorganische und allgemeine Chemie”. 211 (1–2), s. 204–208, 1933. DOI: 10.1002/zaac.19332110122. (ang.).
- ↑ A.J. Bridgeman, J. Rothery. Bonding in mixed halogen and hydrogen peroxides. „Journal of the Chemical Society, Dalton Transactions”. 1999 (22), s. 4077–4082, 1999. DOI: 10.1039/a904968a. (ang.).
- ↑ A.G. Streng. The Chemical Properties of Dioxygen Difluoride. „Journal of the American Chemical Society”. 85 (10), s. 1380–1385, 1963. DOI: 10.1021/ja00893a004. (ang.).
- ↑ I.J. Solomon, et al.. New Dioxygenyl Compounds. „Inorganic Chemistry”. 3 (3), s. 457, 1964. DOI: 10.1021/ic50013a036. (ang.).