Fluorek tionylu
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||
| Wzór sumaryczny |
SOF | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
86,06 g/mol | ||||||||||||||||||||||||
| Wygląd |
bezbarwny gaz | ||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||
| Podobne związki |
chlorek tionylu (SOCl | ||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||
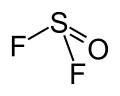
Fluorek tionylu, SOF
2 – nieorganiczny związek chemiczny, bezbarwny gaz o temperaturze topnienia ok. −130 °C i wrzenia ok. −44 °C. Ma strukturę piramidy trygonalnej z atomem siarki na wierzchołku. Kąty O−S−F mają wartość 106,2°, a kąt F−S−F 92,2°[2].
Można go otrzymać w wyniku wymiany chlor–fluor pomiędzy chlorkiem tionylu (SOCl
2), a trifluorkiem antymonu (SbF
3)[2]:
- 3SOCl
2 + 2SbF
3 → 3SOF
2 + 2SbCl
3
Jest również produktem spontanicznej hydrolizy (z wilgoci z powietrza) tetrafluorku siarki (SF
4) powstającego z rozpadu heksafluorku siarki (SF
6) w łuku elektrycznym[4].
Podobnie jak inne halogenowe związki tionylu, łatwo ulega hydrolizie do fluorowodoru i dwutlenku siarki:
- SOF
2 + H
2O → 2HF + SO
2
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e f CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-90, 9-66, ISBN 978-1-4987-5429-3 (ang.).
- ↑ a b c d Arnold F. Holleman, Egon Wiberg, Inorganic Chemistry, Academic Press, 2001, s. 542, ISBN 0-12-352651-5.
- ↑ Thionyl fluoride, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 122707 [dostęp 2020-06-25] (niem. • ang.).
- ↑ Federico Pepi i inni, Thionyl Fluoride from Sulfur Hexafluoride Corona Discharge Decomposition: Gas-Phase Chemistry of (SOF2)H+ Ions, „Journal of Physical Chemistry A”, 106 (40), 2002, s. 9261–9266, DOI: 10.1021/jp021074v.