Zarodziec sierpowaty
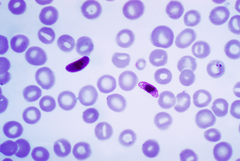 Mikrogametocyty i makrogametocyty zarodźca sierpowatego (rozmaz krwi wybarwiony metodą Giemsy) | |
| Systematyka | |
| Domena | |
|---|---|
| Supergrupa | |
| Nadtyp | |
| Typ | |
| Podtyp | |
| Gromada | |
| Rząd | |
| Rodzina | |
| Rodzaj | |
| Podrodzaj | |
| Gatunek |
zarodziec sierpowaty |
| Nazwa systematyczna | |
| Plasmodium falciparum (Welch, 1897) Schaudinn, 1902 | |
Zarodziec sierpowaty, zarodziec sierpowy (Plasmodium falciparum) – gatunek protista zaliczany do apikompleksów, jeden z kilku pasożytów wewnątrzkomórkowych, które wywołują malarię u ludzi. Został zaklasyfikowany jako jeden z dwóch (obok bąblowca wielojamowego) najbardziej niebezpiecznych pasożytów dla człowieka według Rozporządzenia Ministra Środowiska z dnia 29 listopada 2002 r. w sprawie listy organizmów patogennych (Dz.U. z 2002 r. nr 212, poz. 1798)[2].
W 2002 roku zsekwencjonowano cały jego genom. Ma on wielkość ok. 23 mln par zasad i składa się z 14 chromosomów, na których znajduje się ponad 5000 genów[3].
Morfologia[edytuj | edytuj kod]
W erytrocytach gatunek ten przybiera pierścieniowatą formę z małą obwódką we wczesnym okresie oraz intensywnie zaznaczoną w rosnącym trofozoicie. Czasami w pojedynczej komórce może występować kilka pierścieni. Dojrzałe schizonty i trofozoity występują w niektórych narządach (np. wątroba, śledziona, szpik kostny) oraz we krwi. Jego półksiężycowate mikrogametocyty i makrogametocyty wyglądają bardzo podobnie, pojawiają się po 7–10 dniach zakażenia i zajmują całą objętość erytrocytu.
Ekologia[edytuj | edytuj kod]
Występuje głównie w Afryce Subsaharyjskiej, w klimacie równikowym (tropikalnym).
Zasięg występowania tego gatunku jest ściśle skorelowany z występowaniem jego wektorów, tj. niektórych komarów widliszków (Anopheles): widliszek plamistoskrzydły (A. maculipennis), A. quadrimaculatus, A. gambiae oraz innych lokalnych gatunków.
Chorobotwórczość[edytuj | edytuj kod]
Zarodziec sierpowaty wywołuje odmianę malarii nazywany malarią tropikalną (łac. plasmodis s. malaria tropica), o krótkim okresie inkubacji (8–11 dni) i ciężkich napadach pojawiających się co 36–48 godzin przez 2–3 tygodnie. Samo zakażenie utrzymuje się natomiast 6–17 miesięcy. W tym czasie dochodzi do znacznej niedokrwistości oraz zajęcia ośrodkowego układu nerwowego (OUN), co nierzadko bywa śmiertelne. W pierwszych dniach zakażenia dochodzi do zwiększenia liczby trombocytów (płytek krwi), które hamują wzrost zarodźca sierpowatego, jednak po 7–14 dniach dochodzi do znacznego zmniejszenia ich liczby (małopłytkowość). W przypadku zakażenia kobiety w ciąży istnieje ryzyko uszkodzenia łożyska, wskutek czego może dojść do śmierci płodu lub przedwczesnego porodu. Jeżeli ciąża zostanie donoszona do końca, zwykle noworodki zakażonych matek mają mniejszą masę urodzeniową. Czasami mogą także urodzić się z wrodzoną malarią.
Wyróżnia się trzy postacie malarii tropikalnej:
- mózgowa – zatory naczyń włosowatych w mózgu, hipoglikemia oraz zaburzony metabolizm neuroprzekaźników objawiają się zaburzeniami świadomości, drgawkami i śpiączką;
- biegunkowa – przypomina cholerę lub dyzenterię (czerwonkę);
- krwotoczna.
U osób z obniżonym poziomem dehydrogenazy glukozo-6-fosforanowej (G6PD) w erytrocytach, jak również u chorych na niedokrwistość sierpowatą malaria rozwija się rzadko.
Pomimo prowadzenia wielu akcji profilaktycznych, w ostatnich latach w wielu krajach Afryki i Ameryki Południowej panuje trend wzrostowy występowania malarii wywoływanej przez ten gatunek. Co więcej, w niektórych regionach zarodźce te mogą być odporne na poszczególne leki (np. chlorchina, pirymetamina, chinina, prymachina, a w Subregionie Wielkiego Mekongu również na artemizyniny). Niektóre szczepy P. falciparum wykształciły mutacje w genach kodujących antygeny wykrywane przez testy bibułowe (RDTs), przez co możliwe są wyniki fałszywie ujemne[1].
Cykl życiowy[edytuj | edytuj kod]

Pokolenie bezpłciowe rozmnaża się w organizmie człowieka na drodze schizogonii, natomiast pokolenie płciowe rozmnaża się w organizmie samicy komara na drodze sporogonii.
Samica komara wraz z ukłuciem wprowadza do krwi człowieka sporozoity, które następnie wnikają do wątroby (trwa to 30–60 minut). Sporozoity rozwijają się dalej (schizogonia pozakrwinkowa), przyjmują formę okrągłą lub owalną, a ostatecznie przekształcają się w pierścieniowy schizont.
Schizonty dojrzewają, po czym dzielą się wielokrotnie na merozoity, które infekują hepatocyty oraz erytrocyty. W tych ostatnich zachodzi schizogonia krwinkowa, podczas której forma pierścieniowa przekształca się w trofozoit i schizont (zajmują one wówczas nawet objętości 2/3 krwinki). W pełni dojrzałe schizonty (merocyty) dzielą się (merulacja) i rozpadają na 12–24 (zwykle 16) merozoitów, które zarażają dalej kolejne erytrocyty.
Po kilku (zwykle 3) dniach z części merozoitów powstają makrogametocyty i mikrogametocyty, które dostają się do jelita komara, gdy zainfekowany człowiek zostanie ponownie ugryziony. Mikrogametocyt przekształca się w 4–6 ruchliwych mikrogamet, natomiast makrogametocyt w jedną nieruchliwa makrogametę (sporogonia). Obie gamety łącza się tworząc ruchliwą, uwicioną zygotę (ookinetę). Ta następnie wnika pod nabłonek jelita komara i przekształca się w oocystę, która z kolei przekształca się w sporocystę, po której pęknięciu uwalniane są sporozoity, przedostające się do gruczołów ślinowych komara.
Leczenie[edytuj | edytuj kod]
Podobnie jak w przypadku zarodźca ruchliwego (P. vivax), lekiem z wyboru w leczeniu malarii wywołanej przez zarodźca sierpowatego jest chlorochina. Na obszarach gdzie spotykane są szczepy oporne na chlorochinę, lekiem pierwszego rzutu jest artesunat albo meflochina. Niestety, w przypadku tej odmiany malarii skuteczność leczenia jest znacznie niższa.
W przypadku zakażenia przez pasożyta ośrodkowego układu nerwowego (OUN) stosuje się dożylne podawanie kwasu acetylosalicylowego oraz heparyny drobnocząsteczkowej (LMWH).
Zobacz też[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ a b Kuna A., Gajewski M.: Malaria. W: Choroby zakaźne i pasożytnicze. Flisiak R. (red.). T. IV. Wydawnictwo Czelej, 2020.
- ↑ Rozporządzenie Ministra Środowiska z dnia 29 listopada 2002 r. w sprawie listy organizmów patogennych oraz ich klasyfikacji, a także środków niezbędnych dla poszczególnych stopni hermetyczności (Dz.U. z 2002 r. nr 212, poz. 1798).
- ↑ Malcolm J. Gardner, Neil Hall, Eula Fung, Owen White, Matthew Berriman, Richard W. Hyman, Jane M. Carlton, Arnab Pain, Karen E. Nelson, Sharen Bowman, Ian T. Paulsen, Keith James, Jonathan A. Eisen, Kim Rutherford, Steven L. Salzberg, Alister Craig, Sue Kyes, Man-Suen Chan, Vishvanath Nene, Shamira J. Shallom, Bernard Suh, Jeremy Peterson, Sam Angiuoli, Mihaela Pertea, Jonathan Allen, Jeremy Selengut, Daniel Haft, Michael W. Mather, Akhil B. Vaidya, David M. A. Martin, Alan H. Fairlamb, Martin J. Fraunholz, David S. Roos, Stuart A. Ralph, Geoffrey I. McFadden, Leda M. Cummings, G. Mani Subramanian, Chris Mungall, J. Craig Venter, Daniel J. Carucci, Stephen L. Hoffman, Chris Newbold, Ronald W. Davis, Claire M. Fraser, Bart Barrell. Genome sequence of the human malaria parasite Plasmodium falciparum. „Nature”. 419 (6906), s. 498–511, 2002. DOI: 10.1038/nature01097. PMID: 12368864.
Bibliografia[edytuj | edytuj kod]
- Antoni Deryło (red.), Parazytologia i akaroentomologia medyczna, Warszawa: Wydawnictwo Naukowe PWN, 2011, s. 131–135, ISBN 978-83-01-13804-2.
