Metateza
Metateza (łac. metathesis, z gr. μετάθεσις metáthesis „przestawienie”)[1][2] – reakcja chemiczna przebiegająca według ogólnego schematu:
- A–B + C–D ⇌ A–D + C–B
W wyniku tej reakcji fragmenty reagujących cząsteczek „zamieniają się miejscami” w skoordynowany sposób.
Metateza w chemii nieorganicznej[edytuj | edytuj kod]
W chemii nieorganicznej reakcje metatezy znane są także pod nazwą reakcji podwójnej wymiany[3][4]. Należą do nich. m.in. reakcje zobojętniania i strącania, np.
Metateza olefin[edytuj | edytuj kod]
Definicja i omówienie[edytuj | edytuj kod]
Metateza olefin to wymiana dwóch fragmentów alkilidenowych z utworzeniem dwóch nowych olefin. W 1967 Calderon jako pierwszy zaproponował nazwę metateza w opisie tej reakcji. Słowo metateza pochodzi z języka greckiego (metathesis) i oznacza zmianę pozycji (meta- zmieniać, thesis-pozycja). Reakcje metatezy olefin katalizowane alkilidenowymi związkami kompleksowymi metali przejściowych stały się atrakcyjną metodą umożliwiającą powstanie nowego wiązania podwójnego węgiel-węgiel[5][6][7]. W odróżnieniu od wielu reakcji organicznych w przypadku metatezy olefin nie powstają niepożądane, stechiometryczne ilości produktów ubocznych takich jak sole (reakcje substytucji nukleofilowej) czy tlenki fosfin (Reakcje Wittiga)[8]
Historia[edytuj | edytuj kod]
Reakcję metatezy odkrył w latach 50. XX w. Karl Ziegler. Jednak dopiero Yves Chauvin w 1971 roku podał jej szczegółowy mechanizm i określił katalizujące ją metale. W 1967 roku Calderon jako pierwszy użył terminu metateza olefin, który zastąpił określenie dysproporcjonowanie. W 1990 Richard Schrock opracował katalizatory reakcji w oparciu o molibden i prazeodym (tzw. katalizatory molibdenowe Schrocka), a profesor Robert Grubbs dwa lata później (w 1992) otrzymał katalizator rutenowy (katalizatory tego typu znane są obecnie jako katalizatory Grubbsa), który umożliwia przeprowadzenie bardzo wydajnych reakcji metatezy w roztworze. Dzięki wprowadzonym do metatezy katalizatorom rutenowym, jest to niezwykle efektywna metoda syntetyczna. Umożliwia ona m.in. syntezę leków, tworzyw sztucznych, herbicydów, dodatków do paliw oraz feromonów. Metoda metatezy służy do zamykania dużych pierścieni i tworzenia długich łańcuchów.
W roku 2005 Chauvin, Schrock i Grubbs otrzymali nagrodę Nobla w dziedzinie chemii[9].
Mechanizm[edytuj | edytuj kod]
Bezpośrednia [2+2] cykloaddycja dwóch alkenów jest formalnie zabroniona symetrią i dlatego ma wysoką energię aktywacji. Mechanizm Chauvina obejmuje [2+2] cykloaddycję podwójnego wiązania alkenu do alkilidenu metalu przejściowego z wytworzeniem metalacyklobutanu jako stanu pośredniego. Wytworzony metalacyklobutan spontanicznie ulega fragmentacji w której uzyskuje się związek początkowy (cykl bezproduktywny) lub nowego alkenu i alkilidenu (Cykl produktywny). Oddziaływanie z orbitalami d na katalizatorze metalicznym obniża energię aktywacji na tyle, że obecnie stosowane katalizatory pozwalają na osiąganie stanu równowagi w temperaturze pokojowej w zaledwie kilka minut[10][11].

W przypadku tego rodzaju reakcji dochodzi zazwyczaj do niewielkiej zmiany entalpii (wyjątek stanową m.in. związki o naprężonych pierścieniach takich jak norbornen, Wykorzystuje się to w procesie ROMP). Metateza olefin zazwyczaj jest procesem napędzanym zwiększaniem się entropii układu
Katalizatory[edytuj | edytuj kod]
Spośród metali przejściowych obecnie najszersze zastosowanie w metatezie olefin w roztworach znajdują dwa metale: Molibden i Ruten. Z kolei w wielkotonażowych procesach przemysłowych (np. przemysł petrochemiczny) szerokie zastosowanie znajdują tlenki Renu (Re2O7) osadzone na nośnikach stałych (np. tlenek glinu Al2O3)
Katalizatory molibdenowe[edytuj | edytuj kod]
Schrock wszedł na pole metatezy olefin w 1979 roku jako rozszerzenie prac nad alkilidenami tantalu[12]. Początkowy wynik był rozczarowujący, ponieważ reakcja CpTa(=CH–t–Bu)Cl2 z etylenem dała tylko metalacyklopentan, a nie produkty metatezy[13].

Jednak w 1990 roku Schrock opublikował alkilidenowe katalizatory molibdenowe, nazywane od nazwiska twórcy, katalizatorami Schrocka, zawierają centra metaliczne na bazie molibdenu(VI) oraz ligandy alkoksylowe oraz imidkowe, tworząc niezwykle aktywne i efektywne układy katalityczne[14][15]:

Katalizatory rutenowe[edytuj | edytuj kod]
Alkilidenowe Katalizatory Rutenowe, nazywane katalizatorami Grubbsa lub Hoveydy-Grubbsa, zawierają centa metaliczne na bazie rutenu(II), 2 ligandy anionowe (najczęściej chlorki), oraz 2-3 ligandy neutralne (alkilowe fosfiny, karbeny N‑heterocykliczne bądź pirydyny). W przypadku katalizatorów rutenowych wyróżniane są 3 generacje kompleksów[8], jednak to dwie pierwsze z nich odgrywają kluczową rolę w katalizie. Katalizatory rutenowe charakteryzują się dużo większą trwałością na czynniki zewnętrzne (tlen, wilgoć) w porównaniu do katalizatorów molibdenowych. Dodatkowo wykazują znacznie wyższą tolerancje na grupy funkcyjne w substratach, lecz to katalizatory molibdenowe posiadają znacznie wyższą aktywność[16].
Katalizatory I generacji[edytuj | edytuj kod]

W przypadku I generacji kompleksów wyróżniają się dwa kompleksy – Katalizator Grubbsa I generacji (na górze) oraz katalizator Hoveydy-Grubbsa I generacji. W tym przypadku, jak i w przypadkach następnych, jeżeli kompleks posiada ligand alkilidenowy połączony z ligandem neutralnym (izopropoksylowym) tworząc ligand chelatujący, kompleksy noszą nazwę katalizatorów Hoveydy-Grubbsa[8]

Katalizatory II generacji[edytuj | edytuj kod]


Katalizatory II generacji posiadają w swojej strukturze N-heterocykliczne karbeny, które powodują znaczące poprawienie się zarówno aktywności, jak i stabilności katalizatorów rutenowych. Tak jak poprzednio wyróżniamy katalizatory typu Grubbsa II generacji oraz Hoveydy-Grubbsa II generacji[17]. Katalizatory Hoveydy-Grubbsa II generacji wykazywały się wysoką trwałością, niestety połączone z niską aktywnością. Rozwiązaniem tego problemu był katalizator opracowany przez polskiego chemika Karola Grelę, posiadający grupę nitrową w pierścieniu arylowym ligandu alkilidenowego. Dodanie grupy EWG spowodowało uzyskanie struktury która znacznie szybciej ulegała aktywacji[18].

Katalizatory selektywne[edytuj | edytuj kod]
W przypadku stosowania standardowych katalizatorów w warunkach reakcji powstają mieszaniny E/Z produktów (E:Z ≈ 8:2). W przypadku tworzenia molekuł o znaczeniu biologicznym, w których najczęściej obecnym wiązaniem jest to o konfiguracji Z, cenną metodologią jest taka, która pozwala na kontrolę geometrii powstającego wiązania podwójnego[19]
Z-Selektywne[edytuj | edytuj kod]
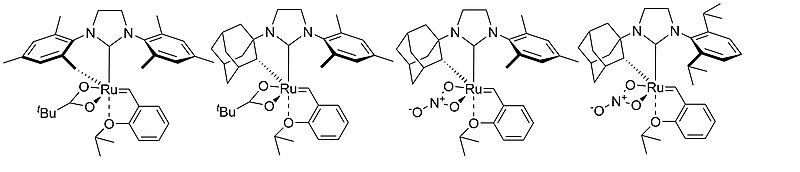
W zastosowaniu metatezy olefin w nowoczesnej syntezie organicznej bardzo istotna jest kontrola konfiguracji wiązania podwójnego C=C. Pierwsze doniesienie literaturowe na temat Z‑selektywnych rutenowych katalizatorów metatezy olefin pochodzi z 2011 roku[20]. W tej publikacji naukowej Grubbs et al. opisał kompleksy rutenu zawierające symetryczne i niesymetryczne ligandy NHC zawierające przy atomie azotu podstawnik mezytylowy oraz adamantylowy, a także anionowy ligand kwasu piwalowego (tBuCOO−). Następnie, zespół prof. Grubbsa otrzymał analogiczne struktury, w których ligandem anionowym jest reszta kwasu nitrowego[21]. Katalizatory te wykazywały wysoką chemoselektywność względem terminalnych wiązań podwójnych C=C, które selektywnie tworzą w reakcji metatezy olefin produkty o konfiguracji Z.
Rodzaje metatezy[edytuj | edytuj kod]
Metateza Krzyżowa (CM)[edytuj | edytuj kod]

Metateza krzyżowa (dysproporcjonującą) – cross-metathesis (CM) jest stosowana w przemyśle rafineryjnym do zwiększania liczby oktanowej surowej benzyny. Reakcję tę w przemyśle rafineryjnym prowadzi się w wysokiej temperaturze, z użyciem katalizatorów wolframowych (np.: WCl6–EtOH–EtAlCl2). Na skutek reakcji metatezy mieszaniny alkenów obecnych w destylacie z ropy naftowej powstają rozgałęzione alkany, które mają wysokie liczby oktanowe i wzbogacają surową benzynę. Proces ten został opracowany przez firmę Shell i jest znany jako „SHOP” (z ang. Shell higher olefin process).
Etenoliza[edytuj | edytuj kod]
Etenoliza to proces chemiczny, w którym wewnętrzne olefiny są degradowane przy użyciu etylenu (eten) jako odczynnika. Reakcja jest szczególnym przypadkiem metatezy krzyżowej. Użyteczność reakcji wynika z niskiego kosztu etylenu jako odczynnika i jego selektywności. Wytwarza związki z końcową grupą funkcyjną alkenów (α-olefiny), które są bardziej podatne na inne reakcje, takie jak polimeryzacja i hydroformylowanie. Kompleksy rutenowe drugiej generacji z cyklicznymi (alkilo)(cyklicznymi)karbenami (Ru−CAAC) są chętnie wykorzystywane w tej rekacji z uwagi na swoją zwiększoną stabilność, co implikuje niskie załadunki katalizatora (< 10 pmm)[22].
Ogólne równanie reakcji to:
A=B + CH2=CH2 → A=CH2 + B=CH2
W jednym zastosowaniu neoheksen, prekursor perfum, jest wytwarzany przez etenolizę diizobutenu[23]:
(CH3)3C-CH=C(CH3)2 + CH2=CH2 → (CH3)3C-CH=CH2 + (CH3)2C=CH2
Metatezę z zamknięciem pierścienia (RCM)[edytuj | edytuj kod]
Metateza z zamknięciem pierścienia – ring-closing metathesis (RCM) – jest szeroko stosowaną odmianą metatezy olefin w chemii organicznej do syntezy różnych nienasyconych pierścieni poprzez wewnątrzcząsteczkową metatezę dwóch terminalnych alkenów, które tworzą cykloalken jako izomery E- lub Z- i lotny etylen[24].

Najczęściej syntetyzowane rozmiary pierścieni mieszczą się w zakresie od 5 do 7 atomów[25]; jednak raportowano syntezy od 45 do nawet 90-członowych makroheterocykli[26][27][28]. Reakcja ta została po raz pierwszy opublikowana przez Didera Villemina w 1980 r., opisująca syntezę prekursora egzaltolidu[29], a później została spopularyzowana przez Roberta H. Grubbsa i Richarda R. Schrocka[30][31]. RCM jest ulubioną reakcją chemików organicznych ze względu na jego syntetyczną użyteczność w tworzeniu pierścieni, które wcześniej były trudno dostępne, oraz szeroki zakres substratów[32]. Ponieważ jedynym produktem ubocznym jest etylen, reakcje te można również uznać za atomowo ekonomiczną, co jest coraz ważniejszą kwestią w rozwoju zielonej chemii.
Polimeryzację z metaetycznym otwarciem pierścienia (ROMP)[edytuj | edytuj kod]
Polimeryzację z metatetycznym otwarciem pierścienia – ring-opening metathesis polymerization (ROMP) – Inną reakcją o dużym praktycznym zastosowaniu jest ROMP (z ang. ring opening metathesis polymerisation), czyli polimeryzacja przez metatezę z otwarciem pierścienia (polimeryzacja z metatetycznym otwarciem pierścienia):

Dzięki tej reakcji stało się możliwe uzyskanie wielu poliolefin, których nie można było otrzymać w wyniku zwykłej polimeryzacji winylowej. Poliolefiny te są stosowane m.in. jako powłoki płyt CD i powłoki zabezpieczające powierzchnie natarcia skrzydeł samolotowych.
Reakcja metatezy jest też bardzo wygodnym sposobem otrzymywania czynnych optycznie związków chemicznych, których nie można otrzymać w inny sposób, co rozszerzyło znacznie metody dostępne w ramach syntezy asymetrycznej:

Metateza acyklicznych dienów (ADMET)[edytuj | edytuj kod]
Metateza acyklicznych dienów – ADMET (acyclic diene metathesis) to specjalny rodzaj metatezy olefin stosowanych do polimeryzacji końcowych dienów do polienów:

Powstające nowe wiązania podwójne mogą być w konfiguracji cis lub trans. Dokładny stosunek zależy od budowy monomeru i katalizatora. ADMET to rodzaj polimeryzacji stopniowej, kondensacyjnej. Należy ją odróżnić od polimeryzacji przez metatezę z otwarciem pierścienia (ROMP), która jest polimeryzacją addycyjną ze wzrostem łańcucha[34]. Podczas gdy ADMET jest napędzany przez uwalnianie lotnego etylenu, ROMP jest napędzany przez zmniejszanie naprężenia pierścienia. Chociaż koncepcja ADMET była omawiana w literaturze naukowej od lat 70., pierwsza udana polimeryzacja ADMET została opisana w 1991 r.[23] W tym raporcie 1,5-heksadien i 1,9-dekadien poddano polimeryzacji odpowiednio do 1,4-polibutadienu i poli(oktenylenu). Polibutadien miał wagowo średnią masę molową (Mw) 28 000 z ponad 70% podwójnymi wiązaniami trans. Poli(oktenylen) miał Mw 108 000 z ponad 90% wiązań podwójnych trans. ADMET znalazł zastosowanie w syntezie różnych polimerów. Ze względu na wyższy stopień kontroli w ADMET niż w tradycyjnych polimeryzacjach rodnikowych, zastosowano go do syntezy polimerów modelowych, które w innym przypadku byłyby trudne do przygotowania. Przykłady obejmują czysto liniowy polietylen, naprzemienne i blokowe kopolimery etylenu z różnymi innymi monomerami winylowymi, chiralne polimery i polimery z osadzonymi aminokwasami[35]. Wysoka tolerancja grup funkcyjnych ADMET katalizowanego rutenem została zastosowana w syntezie nowych struktur supramolekularnych[35].
Metateza wiązań σ[edytuj | edytuj kod]
Metateza wiązań σ, która zachodzi w przypadku wielu związków metaloorganicznych jest reakcją analogiczną do metatezy olefin, w której zamiast pękania i powstawania wiązań podwójnych węgiel-węgiel dochodzi do wymiany wiązań pojedynczych węgiel-metal i węgiel-wodór lub wodór-wodór:
- Cp
2M−R + R'−H ⇄ Cp
2M−R' + R−H- gdzie: M – atom metalu, Cp – ligand cyklopentadienylowy, R, R' – atom wodoru lub grupa alkilowa
Reakcji tej ulegają szczególnie chętnie kompleksy cyklopentadienylowe (Cp) tzw. wczesnych metali przejściowych, tj. znajdujących się w grupach 3 (wraz z lantanowcami), 4 i 5 układu okresowego pierwiastków. Dla tego rodzaju związków reakcja ta zachodzi spontanicznie i ma charakter równowagowy.
Mimo pozornego podobieństwa, reakcja ta ma jednak inny mechanizm niż reakcja metatezy olefin i jest on obecnie[kiedy?] jeszcze nie do końca zrozumiany. Jest to jedna z nielicznych reakcji metaloorganicznych, które zachodzą bez żadnej zmiany stopnia utlenienia metalu centralnego. Ze względu na to, że wczesne metale przejściowe w kompleksach Cp i tak już mają maksymalne, dostępne dla nich stopnie utleniania, mechanizm metatezy wiązań σ nie może zachodzić według klasycznego dla chemii metaloorganicznej mechanizmu z udziałem etapu utleniającej addycji i reduktywnej eliminacji.
Metateza wiązań σ jako samodzielna reakcja chemiczna nie ma zbyt wielu zastosowań. Stosuje się ją czasem do wymiany ligandów w celu uaktywnienia „uśpionego” katalizatora metaloorganicznego. Reakcja ta występuje jednak jako jeden z etapów mechanizmu reakcji wielu procesów stosowanych na skalę przemysłową, m.in. hydrosililowania i polimeryzacji winylowej z użyciem katalizatorów metaloorganicznych.
Przypisy[edytuj | edytuj kod]
- ↑ Władysław Kopaliński, metateza, [w:] Słownik wyrazów obcych i zwrotów obcojęzycznych [online], slownik-online.pl [zarchiwizowane 2013-07-02].
- ↑ Henry George Liddell, Robert Scott, μετάθεσις, [w:] A Greek-English Lexicon [online] [dostęp 2018-07-16] (ang.).
- ↑ Mały słownik chemiczny, Wiedza Powszechna, Warszawa, 1971.
- ↑ metateza, [w:] Encyklopedia PWN [dostęp 2024-06-25].
- ↑ Advanced information on the Nobel Prize in Chemistry 2005. Development of the metathesis method in organic synthesis [online], Nobel Prize Outreach AB, 30 listopada 2005 [dostęp 2024-06-25] (ang.).
- ↑ Olefin Metathesis, Grubbs Reaction [online], Organic Chemistry Portal [dostęp 2024-06-25] (ang.).
- ↑ Andy Nickel, Olefin Metathesis -The Mechanism, 10 września 2009 [zarchiwizowane 2012-06-23] (ang.).
- ↑ a b c Karol Grela, Olefin metathesis. Theory and practice, Hoboken, New Jersey 2014, ISBN 978-1-118-71156-9, OCLC 862222401 [dostęp 2022-04-09].
- ↑ The Nobel Prize in Chemistry 2005. Nobelprize.org, 2005. [dostęp 2014-11-07].
- ↑ Par Jean‐Louis Hérisson, Yves Chauvin, Catalyse de transformation des oléfines par les complexes du tungstène. II. Télomérisation des oléfines cycliques en présence d'oléfines acycliques, „Die Makromolekulare Chemie”, 141 (1), 1971, s. 161–176, DOI: 10.1002/macp.1971.021410112 [dostęp 2024-06-25] (fr.).
- ↑ Adrian Sytniczuk i inni, A tunable family of CAAC-ruthenium olefin metathesis catalysts modularly derived from a large-scale produced ibuprofen intermediate, „Chemical Science”, 14 (39), 2023, s. 10744–10755, DOI: 10.1039/D3SC03849A, PMID: 37829018, PMCID: PMC10566500 [dostęp 2024-06-25] (ang.).
- ↑ R.R. Schrock, P. Meakin, Pentamethyl complexes of niobium and tantalum, „Journal of the American Chemical Society”, 96 (16), 1974, s. 5288–5290, DOI: 10.1021/ja00823a064 [dostęp 2024-06-25] (ang.).
- ↑ S.J. McLain, C.D. Wood, R.R. Schrock, Preparation and characterization of tantalum(III) olefin complexes and tantalum(V) metallacyclopentane complexes made from acyclic .alpha. olefins, „Journal of the American Chemical Society”, 101 (16), 1979, s. 4558–4570, DOI: 10.1021/ja00510a022 [dostęp 2024-06-25] (ang.).
- ↑ Richard R. Schrock i inni, Synthesis of molybdenum imido alkylidene complexes and some reactions involving acyclic olefins, „Journal of the American Chemical Society”, 112 (10), 1990, s. 3875–3886, DOI: 10.1021/ja00166a023 [dostęp 2024-06-25] (ang.).
- ↑ Guillermo C. Bazan i inni, Living ring-opening metathesis polymerization of 2,3-difunctionalized 7-oxanorbornenes and 7-oxanorbornadienes by Mo(CHCMe2R)(NC6H3-i-Pr2-2,6)(O-t-Bu)2 and Mo(CHCMe2R)(NC6H3-i-Pr2-2,6)(OCMe2CF3)2, „Journal of the American Chemical Society”, 113 (18), 1991, s. 6899–6907, DOI: 10.1021/ja00018a028 [dostęp 2024-06-25] (ang.).
- ↑ Robert H. Grubbs i inni, Handbook of metathesis., Second edition, Weinheim, Germany 2015, ISBN 978-3-527-67410-7, OCLC 907676339 [dostęp 2022-04-09].
- ↑ Cezary Samojłowicz, Michał Bieniek, Karol Grela, Ruthenium-based olefin metathesis catalysts bearing N-heterocyclic carbene ligands, „Chemical Reviews”, 109 (8), 2009, s. 3708–3742, DOI: 10.1021/cr800524f, PMID: 19534492 [dostęp 2024-06-25] (ang.).
- ↑ Karol Grela, Syuzanna Harutyunyan, Anna Michrowska, A highly efficient ruthenium catalyst for metathesis reactions, „Angewandte Chemie International Edition”, 41 (21), 2002, s. 4038–4040, DOI: 10.1002/1521-3773(20021104)41:21<4038::AID-ANIE4038>3.0.CO;2-0, PMID: 12412074 [dostęp 2024-06-25] (ang.).
- ↑ Kamal M. Dawood, Kotohiro Nomura, Recent Developments in Z‐Selective Olefin Metathesis Reactions by Molybdenum, Tungsten, Ruthenium, and Vanadium Catalysts, „Advanced Synthesis & Catalysis”, 363 (8), 2021, s. 1970–1997, DOI: 10.1002/adsc.202001117 [dostęp 2024-06-25] (ang.).
- ↑ Koji Endo, Robert H. Grubbs, Chelated Ruthenium Catalysts for Z -Selective Olefin Metathesis, „Journal of the American Chemical Society”, 133 (22), 2011, s. 8525–8527, DOI: 10.1021/ja202818v, PMID: 21563826, PMCID: PMC3121191 [dostęp 2024-06-25] (ang.).
- ↑ Jeffrey S. Cannon, Robert H. Grubbs, Alkene Chemoselectivity in Ruthenium‐Catalyzed Z ‐Selective Olefin Metathesis, „Angewandte Chemie International Edition”, 52 (34), 2013, s. 9001–9004, DOI: 10.1002/anie.201302724, PMID: 23832646, PMCID: PMC3826562 [dostęp 2024-06-25] (ang.).
- ↑ Adrian Sytniczuk i inni, Aza-Claisen rearrangement as a key step in synthesis of specialised anilines used in the production of efficient ethenolysis catalysts, „Catalysis Science & Technology”, 13 (12), 2023, s. 3682–3688, DOI: 10.1039/D3CY00395G [dostęp 2024-06-25] (ang.).
- ↑ a b K.B. Wagener, J.M. Boncella, J.G. Nel, Acyclic diene metathesis (ADMET) polymerization, „Macromolecules”, 24 (10), 1991, s. 2649–2657, DOI: 10.1021/ma00010a001 [dostęp 2024-06-25] (ang.).
- ↑ Sebastien Monfette, Deryn E. Fogg, Equilibrium Ring-Closing Metathesis, „Chemical Reviews”, 109 (8), 2009, s. 3783–3816, DOI: 10.1021/cr800541y [dostęp 2024-06-25] (ang.).
- ↑ Alexander Deiters, Stephen F. Martin, Synthesis of Oxygen- and Nitrogen-Containing Heterocycles by Ring-Closing Metathesis, „Chemical Reviews”, 104 (5), 2004, s. 2199–2238, DOI: 10.1021/cr0200872 [dostęp 2024-06-25] (ang.).
- ↑ Matthew F. Cain i inni, Synthesis of a TREN in Which the Aryl Substituents are Part of a 45 Atom Macrocycle, „Journal of the American Chemical Society”, 135 (41), 2013, s. 15338–15341, DOI: 10.1021/ja408964g [dostęp 2024-06-25] (ang.).
- ↑ Suvankar Dasgupta, Jishan Wu, Template-directed synthesis of kinetically and thermodynamically stable molecular necklace using ring closing metathesis, „Organic & Biomolecular Chemistry”, 9 (9), 2011, s. 3504, DOI: 10.1039/c0ob01034k [dostęp 2024-06-25] (ang.).
- ↑ Kyu Ho Song, Sang Ook Kang, Jaejung Ko, Template Synthesis of a Huge Macrocycle by Olefin Metathesis Using Easily Accessible [Pt(PEt3)2 ] Templates, „Chemistry – A European Journal”, 13 (18), 2007, s. 5129–5134, DOI: 10.1002/chem.200700213 [dostęp 2024-06-25] (ang.).
- ↑ Didier Villemin, Synthese de macrolides par methathese., „Tetrahedron Letters”, 21 (18), 1980, s. 1715–1718, DOI: 10.1016/S0040-4039(00)77818-X [dostęp 2024-06-25] (ang.).
- ↑ Robert H. Grubbs, Olefin‐Metathesis Catalysts for the Preparation of Molecules and Materials (Nobel Lecture), „Angewandte Chemie International Edition”, 45 (23), 2006, s. 3760–3765, DOI: 10.1002/anie.200600680 [dostęp 2024-06-25] (ang.).
- ↑ Richard R. Schrock, Multiple Metal–Carbon Bonds for Catalytic Metathesis Reactions (Nobel Lecture), „Angewandte Chemie International Edition”, 45 (23), 2006, s. 3748–3759, DOI: 10.1002/anie.200600085 [dostęp 2024-06-25] (ang.).
- ↑ Tina M. Trnka, Robert H. Grubbs, The Development of L2X2Ru=CHR Olefin Metathesis Catalysts: An Organometallic Success Story, „Accounts of Chemical Research”, 34 (1), 2001, s. 18–29, DOI: 10.1021/ar000114f [dostęp 2024-06-25] (ang.).
- ↑ Joshua J. Van Veldhuizen i inni, A Recyclable Chiral Ru Catalyst for Enantioselective Olefin Metathesis. Efficient Catalytic Asymmetric Ring-Opening/Cross Metathesis in Air, „Journal of the American Chemical Society”, 124 (18), 2002, s. 4954–4955, DOI: 10.1021/ja020259c [dostęp 2024-06-25] (ang.).
- ↑ Hatice Mutlu, Lucas Montero De Espinosa, Michael A.R. Meier, Acyclic dienemetathesis: a versatile tool for the construction of defined polymer architectures, „Chem. Soc. Rev.”, 40 (3), 2011, s. 1404–1445, DOI: 10.1039/B924852H [dostęp 2024-06-25] (ang.).
- ↑ a b Travis W. Baughman, Kenneth B. Wagener, Recent Advances in ADMET Polymerization, [w:] Michael R. Buchmeiser (red.), Metathesis Polymerization, t. 176, Berlin, Heidelberg: Springer Berlin Heidelberg, 3 lutego 2005, s. 1–42, DOI: 10.1007/b101318, ISBN 978-3-540-23358-9.
Bibliografia[edytuj | edytuj kod]
- Robert H. Grubbs (red.), Handbook of Metathesis. Catalyst Development, Wiley-VCH, 26 sierpnia 2003, DOI: 10.1002/9783527619481, ISBN 978-3-527-30616-9 (ang.).
- A. Maureen Rouhi, Olefin Metathesis: The Early Days, „Chemical & Engineering News”, 80 (51), 23 grudnia 2002, s. 34–38 [dostęp 2024-06-25] (ang.).
- Ileana Dragutan, Valerian Dragutan, Petru Filip, Recent developments in design and synthesis of well-defined ruthenium metathesis catalysts – a highly successful opening for intricate organic synthesis, „Arkivoc”, 10, 2005, s. 105–129 (ang.).
