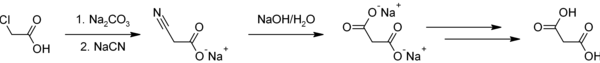Kwas malonowy
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny |
C3H4O4 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory |
HOOC−CH | ||||||||||||||||||||||||||||
| Masa molowa |
104,06 g/mol | ||||||||||||||||||||||||||||
| Wygląd |
bezbarwny[1] | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
Kwas malonowy, kwas propanodiowy, HOOC−CH
2−COOH – organiczny związek chemiczny z grupy kwasów dikarboksylowych. Jego sole i estry są nazywane malonianami. Jego nazwa pochodzi od łacińskiego słowa malum oznaczającego „jabłko”. Posiada własności silnie drażniące skórę i błony śluzowe. Jego moc jest zbliżona do mocy kwasu octowego.
Po podgrzaniu do 150 °C następuje jego dekarboksylacja do kwasu octowego i dwutlenku węgla[1].
Odwadniając kwas malonowy otrzymuje się podtlenek węgla.
Otrzymywanie[edytuj | edytuj kod]
Kwas malonowy można otrzymać z kwasu octowego[5]:
Kwas octowy chloruje się do kwasu chlorooctowego. Tworzy się sól sodową za pomocą węglanu sodu, która następnie reaguje z cyjankiem sodu tworząc sól sodową kwasu cyjanooctowego w reakcji substytucji nukleofilowej. Grupą nitrylową hydrolizuje się za pomocą wodorotlenku sodu do malonianu sodu, który po zakwaszeniu tworzy kwas malonowy.
Patologia[edytuj | edytuj kod]
Kwas malonowy występuje naturalnie w organizmie człowieka i bierze udział w biosyntezie lipidów[6]. Jeśli podwyższonemu stężeniu kwasu malonowego towarzyszy podwyższone stężenie kwasu metylomalonowego, może to świadczyć o chorobie genetycznej spowodowanej mutacją w genie ACSF3 – złożonej kwasicy malonowej i metylomalonowej (CMAMMA, z ang. combined malonic and methylmalonic aciduria). Obliczając stosunek kwasu malonowego do metylomalonowego w osoczu krwi, CMAMMA można odróżnić od klasycznej kwasicy metylomalonowej[7].
Zastosowania[edytuj | edytuj kod]
Kwas malonowy i jego pochodne mają szerokie zastosowanie w przemyśle do produkcji leków, witamin, barwników, klejów, substancji zapachowych, a także w agrochemii[8]. Może być użyty do wprowadzania fragmentu kwasu octowego w łagodnych warunkach w drodze kondensacji Knoevenagela, po której następuje dekarboksylacja. Jako przykład można podać preparatykę kwasu cynamonowego wykorzystywanego do produkcji niesteroidowego leku przeciwzapalnego – acemetacyny. Substancję aromatyczną γ-nonanolakton można także wytworzyć w kondensacji Knoevenagela z kwasu malonowego i heptanalu (heptanaldehyd), a następnie domknięcia pierścienia[8].
Jego ester dietylowy jest wykorzystywany w syntezie organicznej[1].
Warto wspomnieć, że kwas malonowy jest jednym ze składników służących do przeprowadzenia widowiskowej reakcji chemicznej z oscylacjami stężenia składników (reakcja Biełousowa-Żabotyńskiego)[9]
Przypisy[edytuj | edytuj kod]
- ↑ a b c d Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 212, ISBN 83-7183-240-0.
- ↑ a b c d e CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 3-340, 5-93, ISBN 978-1-4987-5429-3 (ang.).
- ↑ Malonic acid, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2021-04-14] (ang.).
- ↑ a b c Kwas malonowy, karta charakterystyki produktu Sigma-Aldrich, Merck, numer katalogowy: M1296 [dostęp 2021-04-14]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Nathan Weiner, Malonic Acid, „Organic Syntheses”, 18 (50), 1938, s. 376, DOI: 10.15227/orgsyn.018.0050 (ang.).
- ↑ Andrzej Witkowski, Jennifer Thweatt, Stuart Smith, Mammalian ACSF3 Protein Is a Malonyl-CoA Synthetase That Supplies the Chain Extender Units for Mitochondrial Fatty Acid Synthesis, „Journal of Biological Chemistry”, 286 (39), 2011, s. 33729–33736, DOI: 10.1074/jbc.M111.291591, PMID: 21846720, PMCID: PMC3190830 (ang.).
- ↑ Monique G.M. de Sain-van der Velden i inni, A New Approach for Fast Metabolic Diagnostics in CMAMMA, t. 30, Berlin, Heidelberg: Springer Berlin Heidelberg, 2016, s. 15–22, DOI: 10.1007/8904_2016_531, ISBN 978-3-662-53680-3, PMID: 26915364, PMCID: PMC5110436 (ang.).
- ↑ a b Harald Strittmatter, Stefan Hildbrand, Peter Pollak, Malonic Acid and Derivatives, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2007, DOI: 10.1002/14356007.a16_063.pub2 (ang.).
- ↑ Marek Orlik, Reakcje oscylacyjne. Porządek i chaos, Wydawnictwa Naukowo-Techniczne, 1996.